自然免疫における補体経路活性化の新しいシグナルパスが発見された:MASP-1, MASP-3は、酵素でもありPRMでもあり二刀流の振る舞い
自然免疫のひとつであるレクチン経路においては、pattern recognition molecules (PRMs)と呼ばれる mannose-binding lectin (MBL), ficolins, collectin-10/-11らが病原菌やウイルスに特有なパターンを認識して結合し、MASP(MBL結合セリンプロテアーゼ)と複合体を作ることで酵素が活性化され、順次補体を活性化して、膜上に膜侵襲複合体(Membrane Attack Complex: MAC)を形成し、病原菌やウイルスを排除すると一般的に理解されています。
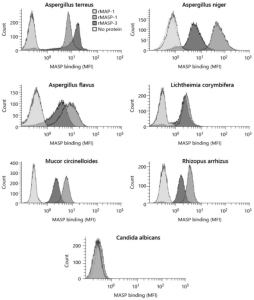
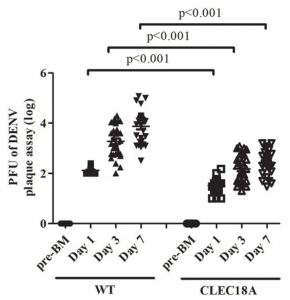
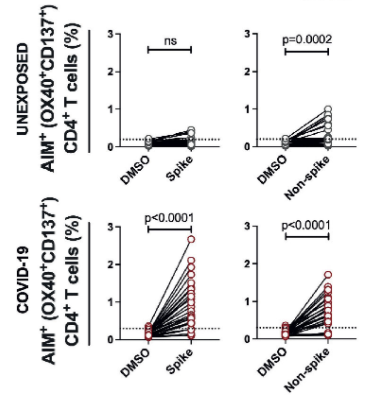
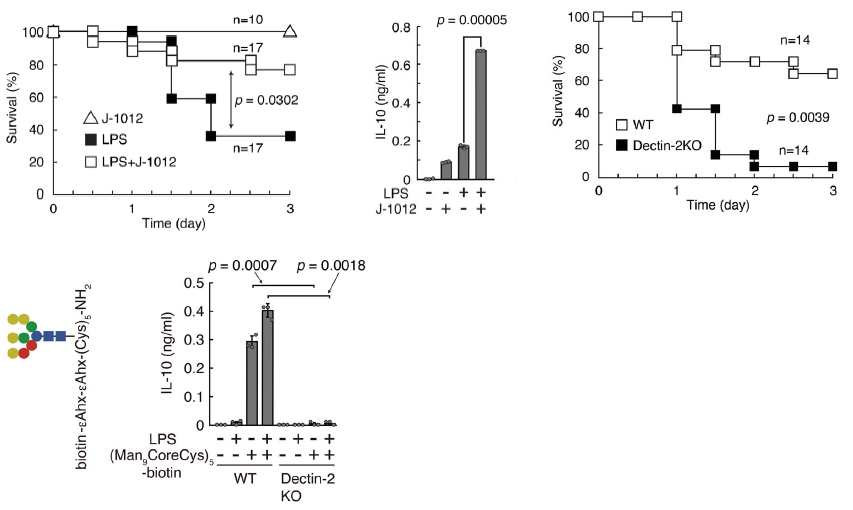
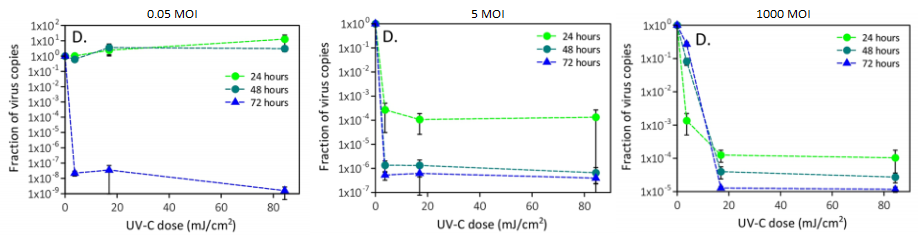
しかし、University of Copenhagenらのグループは、MAPSが直接病原菌に結合し、捕体系路を活性化する場合があることを、Aspergillus fumigatusを用いて実証しています。つまり、捕体系路活性化の新しいシグナルパスが発見されたことになります。MASP-1やMASP-3は、酵素でもありPRMでもあるという二刀流の性格を持つことになります。
https://www.karger.com/Article/FullText/514546