新型コロナウイルス(SARS-CoV-2)のO型糖鎖のサイトスペシフィックな解析
University of Copenhagenらは、新型コロナウイルス(SARS-CoV-2)へのO型糖鎖修飾について報告しています。
https://www.biorxiv.org/content/10.1101/2021.02.03.429627v2
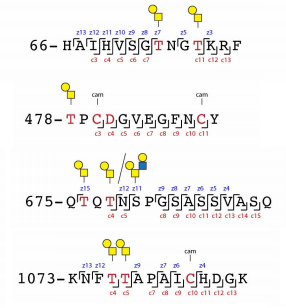
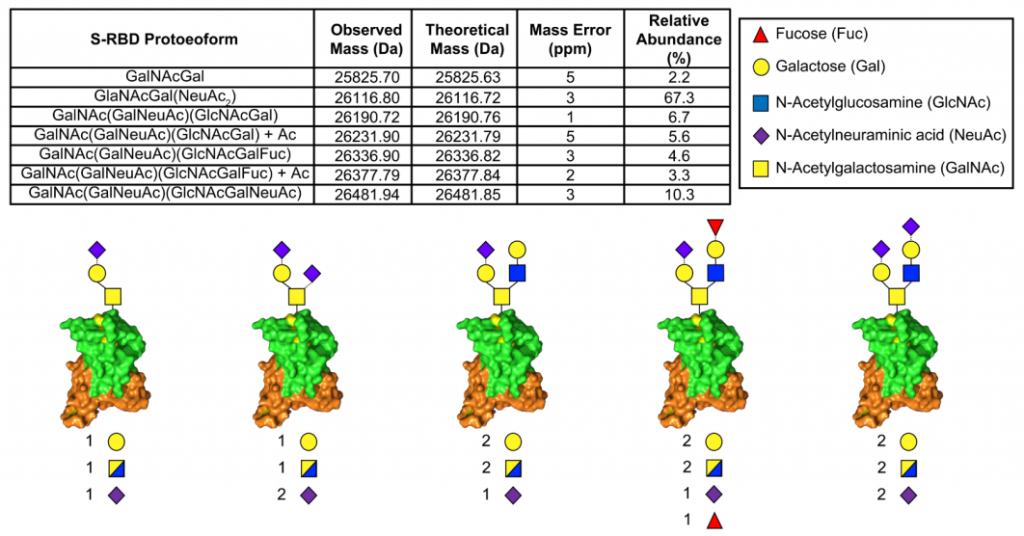
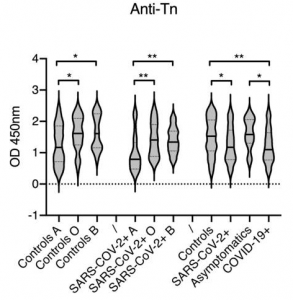
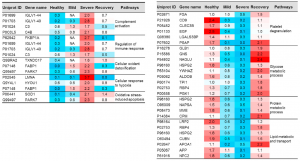
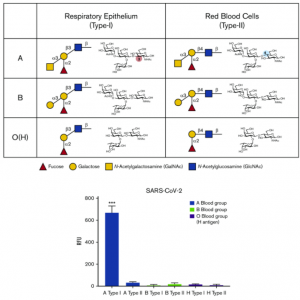
サンプルとしては、昆虫およびHEK293Fで発現したSARS-CoV-2のSpikeタンパク質を使用し、N型糖鎖をPNGase Fで除去し、更にneuraminidaseを用いてシアル酸も除去しています。糖鎖解析には、ETD/HCD LC-MS/MSを使用しています。下記にHEK293 Fの場合のO型糖鎖修飾の様子を抜粋します。相対的にTn抗原よりもT抗原の方が多いようです、但し、シアル酸修飾の状態は不明です。