COVID-19の重症化でα2-6-シアル化が増加する
Department of Chemistry, University of Alberta, Edmonton, Alberta, Canadaらのグループは、COVID-19の重症化でα2-6Siaの発現が昂進すると報告しています.
https://pubmed.ncbi.nlm.nih.gov/35702159/
インフルエンザでは、重症化すると、ハイマンノースと自然免疫レクチンであるMBL2の発現が昂進することが分かっています。また、SARS-CoV-2においては、抗体の糖鎖修飾の変化が重症度のマーカーとなりうるという研究例があります。SARS-CoV-2のスパイクタンパク質に対する抗体の糖鎖修飾が重症患者で変化し、フコシル化とシアル化が低下し、抗体の持つエフェクター機能に潜在的な影響を及ぼします。SARS-CoV-2に対するこのような研究では、単一のタンパク質タイプ(IgG)に焦点が当てられており、今日まで、SARS-CoV-2感染に対する血漿中の糖タンパク質に関する網羅的な研究は行われておらず、感染組織における糖鎖修飾の変化に対する分析もありませんでした。
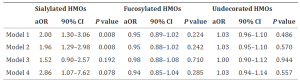
本研究では、COVID-19患者から得られた血漿および剖検サンプルの糖鎖修飾変化を、レクチンマイクロアレイ使用してハイスループット分析しています。この結果、血漿α2,6-シアル化が重症度のマーカーである可能性があることが明らかになりました。このα2,6-シアル化修飾は、IgGを含む血中タンパク質の半減期を延長することが知られています。血漿中では、重度のCOVID-19患者のα2,6-シアル化を受けた補体C5およびC9の割合が有意に昂進していました。これと一致して、COVID-19剖検サンプルにおいても、補体C5およびC9の染色が強くなることが観察されました。
しかし、補体タンパク質のシアル化の機能的重要性は実は良く分かっていません。糖鎖修飾は、血清半減期とタンパク質分解切断に対する耐性の両方を制御する役割を果たし、このカスケードにとって特に重要です。 α2,6-シアル化は半減期を延長し、カスケードからの細胞性損傷を長期化させる可能性があります。もちろん、まだ発見されていない補体生物学に対するα2,6-シアル化の他の効果もあるかも知れません。 α2,6-シアル化および他の糖鎖修飾が補体に及ぼす機能的影響を研究する必要があります。