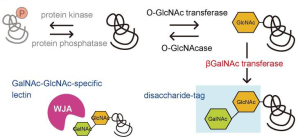
O-GlcNAcを検出するためのGalNAc-GlcNAc 2糖タグとWJAレクチンを用いた方法
東大新領域創成研究科)統合バイオサイエンス学科、らのグループは、O-GlcNAc修飾タンパク質を高感度で検出するための新規な方法を提案しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9126400/
セリンまたはスレオニンのO-GlcNAc修飾は、核または細胞質タンパク質でのみ発生します。この修飾は、幾つかの観点から、N-グリコシル化またはO-グリコシル化とは大きく異なります。
(1)O-GlcNAc修飾は、細胞の核または細胞質で発生しますが、一般的な糖鎖修飾は小胞体およびゴルジ装置の内腔で行われます。
(2)O-GlcNAc修飾は、O-GlcNAc糖転移酵素(OGT)およびO-GlcNAcase(OGA)の作用による可逆反応ですが、N-およびO-糖鎖修飾は不可逆的です。
(3)タンパク質上の一般的なN-型およびO-型糖鎖は、多くの種類の糖転移酵素のプロセッシングを受けて順次処理および伸長されます。しかし、O-GlcNAc残基は他の単糖で修飾されることはありません。
本研究においては、特に細胞核におけるタンパク質のO-GlcNAc修飾を検出するために、可溶性β4GalNAc-TAをコードする発現ベクターを、SV40 T抗原 N-末端またはC-末端のからの核局在化シグナル(NLS)で構築し、β4GalNAc糖転移酵素を用いて、GalNAcをO-GlcNAc化タンパク質のGlcNAc残基に転移させてGalNAcβ1-4GlcNAcの二糖を形成させます。次に、Wisteria japonica凝集素(WJA)レクチンをプローブとして使用し、GalNAcβ1-4GlcNAc二糖を検出します。
本方法は、二糖タグ法と名付けられました。
この方法で使用されるGalNAc-GlcNAcとWJAレクチンの間の結合力は、1.4×10 5 M-1と強いKaを持ち、他のどの方法よりもより高い感度を可能にします。更に、GalNAc-GlcNAc配列を持つ糖鎖は動物細胞ではほとんど発現されないことを強調しておく必要があります。GalNAc-GlcNAc構造は、脳下垂体糖タンパク質ホルモン(ロイトロピン、チロトロピン、フォリトロピン)のN-型糖鎖の非還元末端に見られ、血流からのクリアランスシグナルとして機能します。これらの糖タンパク質ホルモンは脳下垂体にのみ存在し、他の組織や細胞には発現していません。