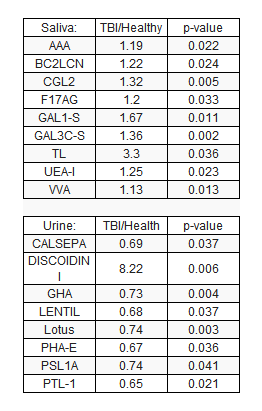
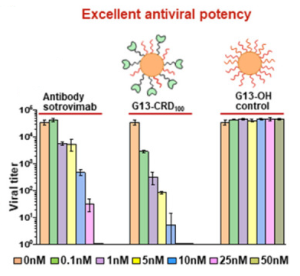
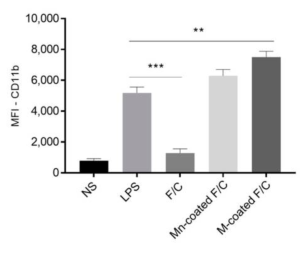
キュウリにキチンオリゴ糖を与えた結果
Institute of Analysis and Testing, Beijing Academy of Science and Technology, Beijing, Chinaらのグループは、オリゴ糖をキュウリに与えた時に起こる根圏細菌叢の変化について報告しています。
https://pubmed.ncbi.nlm.nih.gov/37492253/
オリゴ糖(詳細にはキチンオリゴ糖)がキュウリの葉の老化を効果的に遅らせ、キュウリの生産量を大幅に増加させることが示されました。
根圏とバルク土壌の細菌叢は、様々な処理とサンプリング期間に渡って比較的安定していましたが、メチロバクテリウムとLechevalieriaの存在量を増加させることが示されました。
メチロバクテリウムは、植物が分泌するメタノールを消費することにより、成長を促進する代謝産物を生成することが知られています。