SARS-CoV-2の金ナノ粒子(AuNPs)と金ナノロッド(AuNRs)を用いたSPR検出の比較
Department of Chemistry, University of Warwick, Gibbet Hill Road, Coventry, U.K.らのグループは、SARS-CoV-2の金ナノ粒子(AuNPs)と金ナノロッド(AuNRs)を用いたSPR検出の比較について報告しています。
https://pubs.acs.org/doi/10.1021/acsmacrolett.1c00716
2,3-シアリルラクトースをAuNPsおよびAuNRsに固定化し、SPR検出法を用いてSARS-CoV-2を検出しました。
異方性粒子 (ナノロッドなど) の重要性を強調するために、球状の金ナノ粒子と金ナノロッドを互いに比較しました。
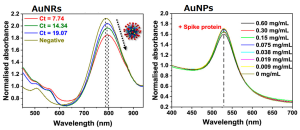
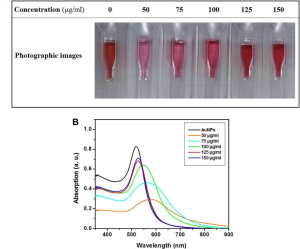
(1)AuNPs (40 nm) は ~520 nm で最大吸収を示し、AuNRs (10 × 38 nm) は ~780 nm で最大吸収を示しました。
(2)AuNPs(凝集によりシグナルを生成する)は、このスパイクタンパク質では有意なスペクトル変化を示しませんでしたが、AuNRsはスパイクタンパク質の濃度の増加とともにスペクトル変化を示しました。
(3) 一次臨床サンプルを使用した AuNRs からのシグナル出力は、RT-PCR からの Ct (サイクル閾値) 値と相関していました。
このようにして、AuNRsを使った方が検出能力が向上することが示されています。