ヒトのDectin-1欠乏症が黒色菌糸症(phaeohyphomycosis)に与える深刻な影響
Fungal Pathogenesis Section and Immunopathogenesis Section, Laboratory of Clinical Immunology and Microbiology (LCIM), National Institute of Allergy and Infectious Diseases (NIAID), NIH, Bethesda, Maryland, USAらのグループは、ヒトのDectin-1欠乏症が黒色菌糸症(phaeohyphomycosis)に対するマクロファージ免疫防御を弱めると報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9663159/
黒色菌糸症は、メラニン産生と糸状増殖を特徴とする皮膚真菌によって引き起こされる侵襲性真菌感染症です。黒色菌糸症は、通常、外傷から感染して皮下組織に影響を及ぼし、抗真菌療法および/または外科的切除で治療可能です。
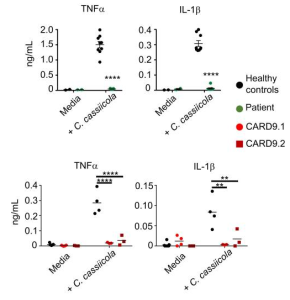
本研究では、CARD9欠損症で生命を脅かす感染症を引き起こすことが知られている植物の黒色真菌であるCorynespora cassiicolaによって引き起こされる重度の黒色菌糸症の患者に焦点が当てられています。この患者は、CARD9 共役受容体である Dectin-1 をコードする CLEC7A に両アレル変異がありました。 Dectin-1 は、ヒト免疫細胞によるこの真菌に対する IL-1β および TNF-α の産生に重要であり、マクロファージによる真菌の殺傷を促進します。 CARD9とは、C-型レクチンのシグナル伝達と抗真菌免疫に関与する骨髄細胞の免疫アダプタータンパク質であります。
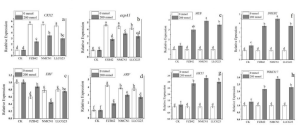
この患者とは血縁関係のない重度の黒色菌糸症患者 17 人も評価され、17 人中 12 人に有害な CLEC7A 変異が存在し、Dectin-1 細胞外、β-グルカン結合、C-末端ドメインらの変化と関連して、Decin-1–依存性サイトカインの産生障害を引きおこしていました。
Dectin-1欠損患者およびCARD9欠損患者のこの真菌に対する炎症誘発性サイトカイン応答の違いを示す