COVID-19の確認された外来患者の場合には、mRNAワクチンの接種は一回で十分のようだ
Northwestern University Feinberg School of Medicine, USAらのグループは、以前にSARS-CoV-2に感染していた人と、していない人の間で、mRNAワクチンの1回或いは2回接種後のIgG中和活性に如何なる違いが生じているかについて報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8276631/
次の三つのグループについて比較しています:
(1)COVID-19群: COVID-19の確認された外来患者で回復した人達、
(2)血清陽性群: SARS-CoV-2のRBDに対して血清陽性ではあるが、COVID-19に対する急性ウイルス診断テストはない人達、
(3)血清陰性群: ワクチン接種前の以前のSARS-CoV-2感染に対して血清陰性の人達。
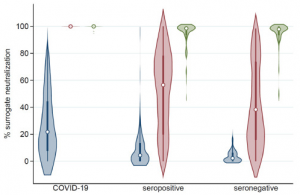
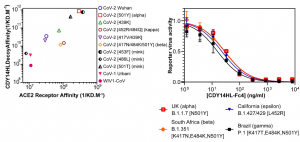
COVID-19群は、中和活性中央値%は、血清陽性群に比べて有意に高い(22.2 vs. 4.4, p < 0.001)。 COVID-19群は、ワクチン接種一回で、血清陽性群に比べて顕著に中和活性中央値%が高い(99.9 vs. 56.5, p < 0.001)。 ワクチン接種一回後、血清陽性群の中和活性中央値%は、明らかに血清陰性群よりも高いが、それほど大きく違うわけではない(56.5 vs. 38.2, p = 0.12)。 COVID-19群は、ワクチン二回接種で、血清陽性群よりも中和活性中央値が高い(99.9 vs. 98.5, p<0.001)。 血清陽性群と血清陰性群は、ワクチン二回接種後はほとんど変わらない中和活性中央値%を示す(98.5 vs. 97.9, p = 0.46)。 従って、結果としては、以前にCOVID-19患者と確認された人達は、ワクチン接種一回で十分な効果が得られるようです。