COVID-19軽症回復期患者における抗体のエフェクター効果(ADCC, ADP)の経時変化について
University of Melbourne, Australiaらのグループは、COVID-19軽症回復期患者におけるFc-依存のエフェクター効果の経時変化について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8106889/
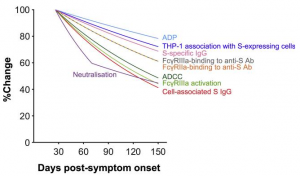
SARS-CoV-2 Spike特異的な抗体がFcγ受容体と結合することで誘起される antibody-dependent cellular cytotoxicity (ADCC) や antibody-dependent phagocytosis (ADP) 活性は、時間経過とともに減衰していきます。本コホートでは、最初のサンプルはSARS-CoV-2感染後の中央値として41日目に採取され、最後のサンプルは感染後の中央値123日目に採取されています。ADCCやADP活性の経時変化は、SARS-CoV-2 Spike特異的なIgGとFcγ受容体結合抗体のそれと相関しています(下図参照)。
重要なことは、Fc-依存のエフェクター効果は、最後のサンプリング時点でほとんどすべての被験者で容易に検出可能(94%)であるのに対し、検出可能な中和活性は同じ時点で70%に留まったということです。全般的に言えるのは、軽症のCOVID-19においては、強いFcγ受容体結合、ADCC、ADP活性らが引き出されており、それらは中和活性の減衰よりも緩やかに減少するということでしょう。