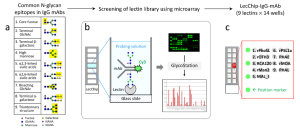
IgG1抗体医薬品評価用のレクチンマイクロアレイ(IgG1-mAb-LecChip: 9 lectins x 14 wells)が生まれた系譜
2011年:
同年11月、FDAに治療用タンパク質のQCに関する特別チームがDr. Baolin Zhangをリーダーとして発足する。
タンパク質の糖鎖修飾に焦点を当て、特にバイオシミラータンパク質製品の評価に関連して、製品の安全性と生物活性に対する影響を評価することを目的とする。
目標は、治療用タンパク質の品質をより適切に評価するために使用できる分析ツールを特定または開発することにある。
2012年:
GPバイオサイエンスの糖鎖プロファイリングシステムGlycoStation(GSR1200とLecChip)についてFDAより見積依頼を受け、同年7月、三者(Dr. Baolin Zhang、本ブログ著者、GPバイオサイエンスの米国代理店社長合田様)がFDAにて会合を持つ。
2013年:
同年10月、グライコテクニカによりGSR1200がFDAに納入設置され、抗体医薬品の評価がLecChip Ver1.0を用いてFDAにてスタートする。
2016年:
その成果がFDAより2本の論文となって発表される。
https://www.tandfonline.com/doi/full/10.1080/19420862.2015.1117719
https://www.tandfonline.com/doi/full/10.1080/19420862.2016.1149662
2017年:
同年7月、抗体医薬品評価用に最適化されたLecChipの開発について、FDAにてキックオフミーティングが開催される(Dr. Baolin Zhang, Dr. Shen Luo, Dr. Lei Zhang、そして本ブログ著者)
合意した14ウェル・18レクチン搭載のLecChipをモデルとして、2019年末から2020年末にかけて数百枚のLecChipが評価用に出荷される。
2021年:
同年6月にGlycoStationの最新鋭機GSR2300がFDAに納入設置される。
2022年:
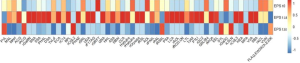
同年3月、83種類のレクチンから最終的に9種類が厳選され、9レクチン・14ウェルLecChip最終版(IgG1-mAb-LecChip: 9 lectins x 14 wells)がFDAに出荷される、
2023年:
1月6日、本ブログ著者が合同会社エムックを設立登記し、FDAとの関係を継承する。
FDAより研究成果が論文として出版される。
https://link.springer.com/article/10.1007/s11095-023-03628-4
9レクチンを搭載するIgG1-mAb-LecChipに関する成果は、同年6月開催のFDAのサイエンスフォーラムで先行発表される。
https://www.fda.gov/science-research/fda-science-forum/rapid-glycan-profiling-nine-lectin-microarray-therapeutic-igg1-monoclonal-antibodies
2024年:
同年1月、9レクチンを搭載するIgG1-mAb-LecChipに関する本論文が出版される。
https://www.tandfonline.com/doi/full/10.1080/19420862.2024.2304268