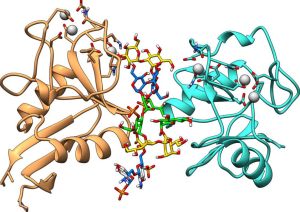
内皮細胞由来の細胞外小胞の糖鎖修飾の特徴
Shemyakin and Ovchinnikov Institute of Bioorganic Chemistry RAS, Moscow, Russiaのグループは、 内皮細胞由来の細胞外小胞の糖鎖修飾の特徴について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11171894/
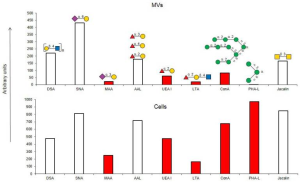
下図に示すように、細胞外小胞の表面糖鎖と内皮細胞の表面糖鎖を比較すると、細胞外小胞の表面糖鎖はN-型糖鎖としてのα2-6-シアル化形態が大半を占めており、Man含有糖鎖のレベルが細胞外小胞で大幅に減少していることが明確に示されています。