大腸がんから分泌されるエクソソームの糖鎖修飾変化をレクチンマイクロアレイで検査する
State Key Laboratory of Electroanalytical Chemistry, Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun, Chinaのグループは、レクチンマイクロアレイを用いたエクソソームの糖鎖プロファイリングについて報告しています。
https://www.sciencedirect.com/science/article/abs/pii/S0003267024006202?via%3Dihub
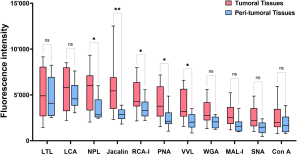
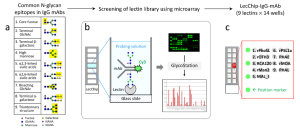
この研究では、レクチンマイクロアレイを用いて、3つの大腸がん細胞株 (SW480、SW620、HCT116) と1つの正常結腸上皮細胞株 (NCM460) の間のエキソソーム表面の比較糖鎖プロファイリング解析が行われています。その結果、UEA-Iレクチンを使用することで、SW480大腸がん細胞由来のエクソソームの異常な糖鎖修飾を検出できることが示されました。
さらに、この実験では、UEA-I レクチンマイクロアレイの検出限界感度 (LOD) は 2.7 × 105個/mLと計算されました。