HepaMN細胞(Hepatocytes)
肝細胞(Hepatocytes)は、医薬品開発におけるin vitro毒性試験のための重要なツールとなっています。
これら肝細胞は、肝臓から新たに単離されたり、肝細胞腫から生成されたり、胚性幹細胞(ESC)や人工多能性幹細胞(iPSC)などの多能性幹細胞から誘導されたり、そしてまた線維芽細胞などの他の体細胞から形質転換されて作られてきました。しかしながら、in vitroモデルとしての肝臓から分離された肝細胞については、限られた供給と遺伝的および環境的背景によるロット間差の影響を受け、その安定供給を保証することが非常に困難です。肝細胞を未分化iPSCまたはESCのバンクから生成する場合でも、完全な幹細胞への分化を保証するためには、その直接的なリプログラミング技術には複雑なプロトコルと比較的長い期間が必要とされ、不均一な細胞集団の中から、限られた量の成熟肝細胞しか得ることができません。
これまでのところ、このような理由から、限られた数の不死化肝細胞しか使用されていません。正常な肝細胞に由来する不死化肝細胞は、安定した供給を確保するために理想的です。この為、HepG2およびHepaRG細胞らが、化学物質および薬物の毒性を評価するために長年使用されてきました。
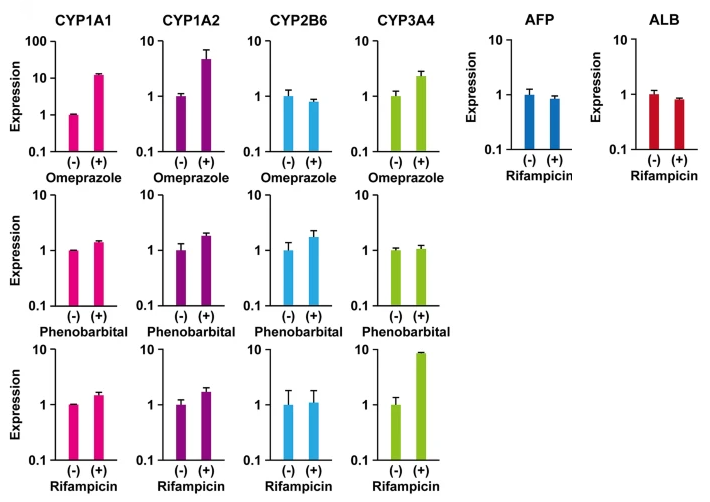
ここでご紹介する胆道閉鎖症の患者から樹立されたHepaMN細胞は、正常な機能と二倍体染色体を備えた最初の不死化肝細胞株です(図1を参照)。 HepaMN細胞がHepaRG細胞と同等のアルブミン遺伝子の発現レベルを示し、in vivoで肝臓のような形態を示すことは最も注目に値します。 ご存じのように、HepG2、Huh7、THLE-2、PLC-PRF-5、およびAML-12などの既存の細胞株が、薬理作用の研究に使用されていますが、HepaMN細胞は、その安定したCYP3A4誘導と構成的アルブミン遺伝子発現を示すが故に、新たな肝細胞モデル細胞としてin vitro毒性試験に役立つ可能性が大いにあるのです(図2を参照)。
最も重要なことは、HepaMN細胞は、2つの重要な肝機能の特徴に関して正常な肝細胞に非常に似ているということです、即ち(1)アルブミンの構成的発現を伴う効率的な細胞増殖を維持できること、そして(2)肝細胞の代謝機能をきちんと持っている、ということなのです。
本HepaMN細胞の入手方法と、推奨培地に関する情報は下記の通りです。
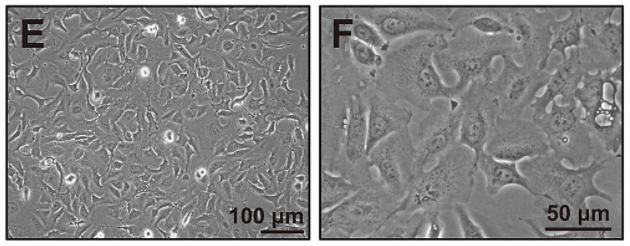
HepaMN入手法
https://cellbank.nibiohn.go.jp/ 細胞名=JCRB1697(HepaMN)にて検索してください。
HepaMN用推奨培地
特殊培地(Culture Media)=EMUKK-15
Reference:https://www.nature.com/articles/s41598-020-73992-3
お問い合わせは、右記へ お問い合わせ
ProliHH細胞(Hepatocytes)
DILI患者の肝臓に由来するProliHH細胞は、肝臓特異的な薬物代謝機能(ピューロマイシン処理)を利用して、増殖可能なヒト肝細胞として樹立されました。
ピューロマイシン処理で選択されたProliHHの肝細胞およびBECマーカーの発現が、長期培養後に調べられました。細胞は、肝細胞および胆管マーカーの遺伝子を発現し続けました。 P4でのピューロマイシン処理細胞におけるチトクロームP450酵素、CYP1A2、CYP2B6、およびCYP3A4の発現は、未処理細胞と比較して高くなっていました。 ALBやAATなどの肝細胞マーカーも、P11およびP17のピューロマイシン処理細胞で高発現していました。対照的に、間葉系細胞マーカーの発現レベルは、ピューロマイシン処理細胞で有意に減少しており、おそらく間葉系細胞の排除とピューロマイシン耐性細胞の選択の結果によるものと考えられます。
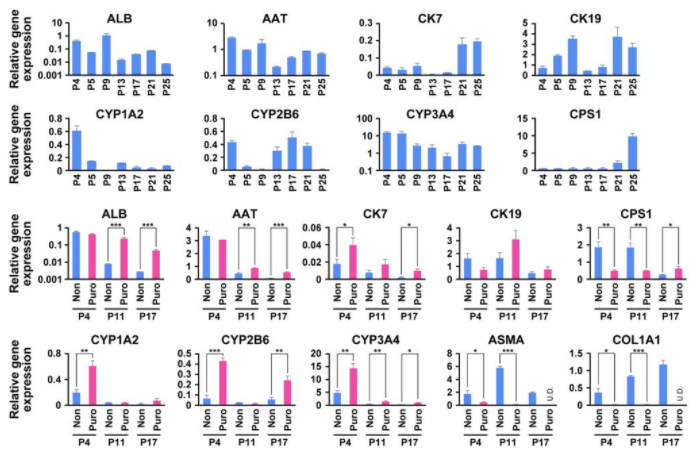
次に、ピューロマイシン処理および未処理のProliHH細胞が可逆的な成熟肝細胞特性を獲得できるかどうかが評価されました。ピューロマイシン処理および未処理のProliHH細胞を、初期(P5)、中期(P11)、および後期(P21またはP25)の継代で、低付着プレートで10日間培養して3次元(3D)培養しました。 3D培養条件下では、ピューロマイシン処理および未処理のProliHH細胞は、継代数に関係なくスフェロイドを形成しました。ピューロマイシン処理および未処理のProliHH細胞の2次元培養では検出できなかったグリコーゲン貯蔵が、3D培養では確認されました。肝細胞マーカー(ALB、CYP3A4、およびMRP2)は、3D培養ピューロマイシン処理および未処理のProliHH細胞で発現していました。肝細胞マーカー、特にALB、AAT、CYP1A2、CYP2B6、およびCYP3A4の発現レベルは、3D培養での成熟とともに有意に増加しましたが、CK7、BEC、および肝細胞前駆細胞マーカーの発現は実質的に抑制されました。ピューロマイシンで処理されたProliHH細胞の成熟が、ProliHH細胞の初期継代と後期継代の両方で観察されたことは注目に値します。
これらの結果は、ピューロマイシンで処理されたProliHH細胞が成熟肝細胞と同様の特性を回復する能力が高いことを示しており、ピューロマイシンが成熟肝細胞の特性を維持するのに効果的であることを示唆しています。
ProliHH入手法
配布準備中
ProliHH用推奨培地
特殊培地=EMUKK-05
Reference:https://www.biorxiv.org/content/10.1101/2021.04.18.440311v2.full
