根圏バクテリアのポテンシャル:赤トウモロコシの根圏細菌 Pseudomonas protegens EMM-1から優れた病原菌阻害物質が見つかった
Benemérita Universidad Autónoma de Puebla (BUAP), Puebla, Pue., Méxicoらのグループは、根圏バクテリア、シュードモナス属のグラム陰性桿菌 EMM-1(Pseudomonas protegens EMM-1)から抽出された病原菌阻害物質について報告しています。
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0240545
Pseudomonas protegens EMM-1 は、赤トウモロコシの根圏から単離されました。そして、そのPseudomonas protegens EMM-1 が効果的に肺炎桿菌や化膿性レンサ球菌らを阻害することが分かりました。
Pseudomonas protegens EMM-1から分泌される阻害物質の実態を調べる為、まず初めに、遠心分離で培養上清液を使用する方法を試しましたが、この中からは阻害物質は見つかりませんでした。代わりに、エタノールを用いた冷却リーチング法で寒天培地から阻害物質が抽出できました。この阻害物質は、下図のように強い阻害活性を示しており、将来、他の阻害物質が更に見つかってくる可能性を示唆します。
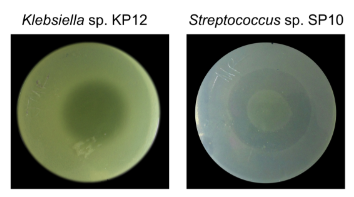
阻害物質の分子サイズは、3 から 10 kDaであると推察されました。阻害活性は 100°C で失われますが、-4°C から 60°Cの間では安定でした。また、pHの影響については、6から8の間で安定でした。残念ながら、本論文では、この阻害物質の分子構造の同定までは行われていません。
しかし、この研究は根圏バクテリアを評価することの重要性を示唆しており、医療や農業において、新しい病原菌阻害剤の開発につながるものと期待されます。