ヒトiPSから分化誘導した糸球体上皮細胞へのSARS-CoV-2の感染には、ACE2以外にBSG/CD147が関与している
Department of Biomedical Engineering, Pratt School of Engineering, Duke University, Durham, NC, USAらのグループは、ヒトのiPS細胞から分化誘導した糸球体上皮細胞へのSARS-CoV-2の感染には、ACE2 以外に BSG/CD147 が関わっていると報告しています。
https://pubmed.ncbi.nlm.nih.gov/34816259/
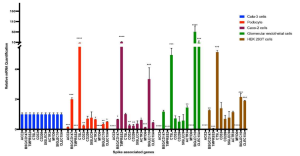
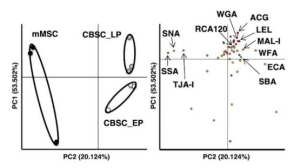
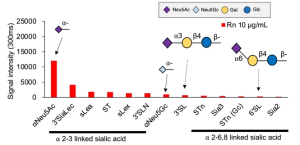
ヒトのiPS細胞から分化誘導した糸球体上皮細胞には、SARS-CoV-2の結合やウイルスの細胞膜融合などに関わると思われる受容体やタンパク質が発現しています(例えば、ACE2、BSG/CD147、TMPRSS2、CTSL、CD33、DC-SIGN/CD209、SIGLEC9、SIGLEC10、ACTR3、CLEC10A 等です)。 Transmembrane Serine Protease 2 (TMPRSS2)、cathepsin L (CTSL) といった酵素は、ウイルスの細胞膜融合や受容体ウイルス複合体の取り込みに関係していることは良く知られています。興味深いことに、ヒトのiPS細胞から分化誘導した糸球体上皮細胞の場合には、Calu-3細胞に比べると、ACE2やTMPRSS2の発現が弱く、逆に、BSG/CD147やCTSLの発現が高くなっていることが分かります(下図参照)。
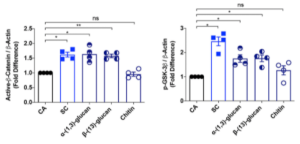
それにもかかわらず、ヒトiPS由来の糸球体上皮細胞は、MOI=0.01~1というウイルス数の少なさで、SARS-CoV-2が感染し、しかも、驚くべきことに、Calu-3細胞やCaco-2細胞よりも、ヒトiPS由来糸球体上皮細胞の方が顕著に多くのウイルスが感染していました(p-value < 0.0001)。ACE2抗体やBSG/CD147抗体で前処理を行うと(0.1 µg/ml)、顕著にウイルス感染が減少し(p-value < 0.0001)、ヒトiPS由来糸球体上皮細胞へのSARS-CoV-2感染には、ACE2とBSG/CD147の両方が関わっていることが示されました。