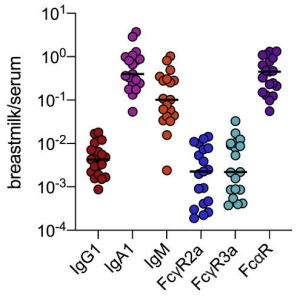
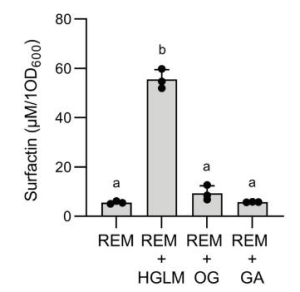
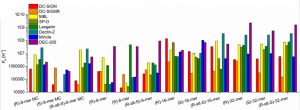
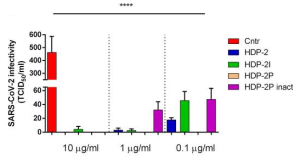
SARS-CoV-2 ワクチンの3回目の接種で起こる免疫反応について:2回目接種の8カ月後に3回目を接種
The Institute of Medical Biology, Chinese Academy of Medical Sciences and Peking Union Medical College, Kunming, Yunnan, Chinaらのグループは、SARS-CoV-2の不活化ワクチンの3回目の接種によっておこる免疫反応について報告しています。
https://pubmed.ncbi.nlm.nih.gov/34666622/
SARS-CoV-2の不活化ワクチンの開発と製造に協力した53人のボランティアが本研究の対象者となっていますが、どのメーカーが開発製造したものであるのかは不明です。被験者は、2020年に、2回のワクチン接種を28日間空けて受けており、2回目の接種から8カ月後に3回目の接種を最近受けました。
3回目の接種後、当日、5日後、7日後、そして14日後に6名のボランティアから血液を採取し、評価されました。SARS-CoV-2のWuhan株に対する抗Spike抗体や中和抗体が接種後5日目以降に立ち上がり、14日後には抗体の正のコンバージョンレートが100%に達しました。興味深いことに、SARS-CoV-2に対するIFN-γ-T細胞反応の記憶も3回接種後に急速に呼び覚まされていました。
このことは、2回の不活化ワクチン接種で誘起される中和抗体は徐々に減少していくのですが、3回目の接種で抗体反応は急速に呼び覚まされ、2回目接種から8カ月経ってもT-細胞記憶もまだ消えていないことを示しています。