Univ. Grenoble Alpes, Franceらのグループは、C型レクチンを介したSARS-CoV-2感染のメカニズムについて報告しています。
https://journals.plos.org/plospathogens/article/authors?id=10.1371/journal.ppat.1009576
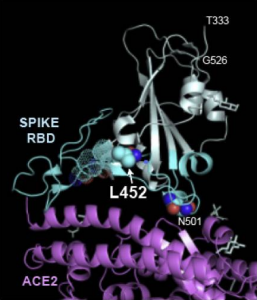
各種C型レクチン(DC-SIGN、L-SIGN、MGL、Langerin)とSARS-CoV-2 spikeタンパク質の分子間相互作用をSPRを用いて検証しました。DC-SIGN、L-SIGN、MGLは、Kd値として μMレンジのアフィニティー(2 ~ 10 μM)を示しました。一方、Langerinは少なくとも1桁以上アフィニティーが低いと判断されました。
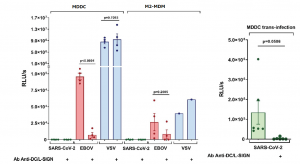
C型レクチンのSARS-CoV-2感染のメカニズムを理解する為に、単球由来樹状細胞(MDDC)、単球由来マクロファージ(M2-MDM)およびVero E6細胞を使用した感染実験が行われました。 興味深いことに、VSV/SARS-CoV-2 疑似ウイルスは、MDDCやM2-MDMがDC-SIGNを発現しているにも関わらず、直接的にはまったく感染しませんでした。しかし、VSV/EBOV-GP疑似ウイルスの場合には、その直接感染が認められ、DC-SIGNを介したシス感染が抗DC/L-SIGN抗体によって阻害されることも示されました(MDDCの場合で92.5%の阻害、M2-MDMの場合で68.4%の阻害でした)。一方、VSV/VSV-G疑似ウイルスは、MDDCにもM2-MDMにも強く感染しましたが、この感染はDC-SIGNとは無関係であります。実際、抗DC-SIGN抗体はEbola Virusの感染に対して何の影響も与えませんでした。
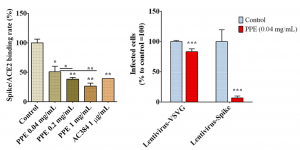
SARS-CoV-2感染におけるDC/L-SIGNの基本的な役割を理解するために、MDDCをSARS-CoV-2と共培養し、そのMDDCをVero E6細胞の培養プレートに加えてみました。因みに、Vero E6細胞はACE2を発現するリファレンス細胞として良く使用されます。興味深いことに、DC-SIGNは、MDDCからVero E6への SARS-CoV-2の感染を促進しました。抗DC-SIGN 抗体をアプライすることで、感染が98%も阻害されることも示されました。これらの実験結果は、DC/L-SIGNのSARS-CoV-2感染における役割が、トランス感染であることを強く示唆しています。