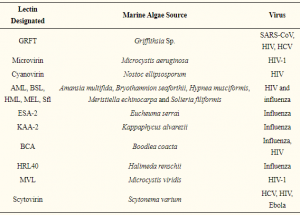
樹状細胞におけるα2-3Sia結合後のシグナルパスについて:α2-3Siaは免疫抑制的に作用する
Vrije Universiteit Amsterdam, Netherlandsのグループは、樹状細胞にα2-3Siaの刺激が入った場合のシグナルパスの変化について議論しています。
https://www.frontiersin.org/articles/10.3389/fimmu.2021.673454/full
樹状細胞(DC)は、細胞膜上のパターン認識受容体(PPR)によって、非常に多様な病原菌らの異物を認識することが出来、MHCとともにその抗原を細胞膜上に提示することによってT-細胞を活性化させます。
シアル酸は、癌の免疫制御において重要な役割を果たしていることが認識されてきています。癌が進行するにつれて、癌細胞の周りに免疫抑制的な微小環境を作り上げるために、シアル酸の修飾を増加させることがしばしば見られます。また、病原菌が免疫を逃れて生き残るために、シアル酸修飾を増加させるという例も良く見られます。
著者らは、樹状細胞において、LPSの刺激下で、α2-3Siaの刺激が入ったときに、リン酸化タンパク質、キナーゼ活性、そしてまたJAK-STATシグナルパスに如何なる変化が起こっているかを調べました。LPSはリポ多糖の略であり、免疫を活性化する場合のモデル物質(エンドトキシン)として良く使用されます。
結果を概観すると、次のようなことが言えます。
α2-3siaの刺激はリン酸化タンパク質を増やすのですが、α2-3sia とLPSで同時に刺激をすると、リン酸化タンパク質が減少します。α2-3Sia刺激を受けた樹状細胞では、α2-3SiaとLPSで同時に刺激したそれに比べて、ERK, AKT1, PKCB, GSK3, PKCD, PAK1, PKA, GSK3, GRK, IκB, RAF1らのキナーゼが減少します(因みに、これらのキナーゼはケモカインのシグナルパスに関係しています)。更に、α2-3siaの刺激は、JAK-STATシグナルパスに、STAT3やSTAT5Aのリン酸化を弱めることによって影響を与えていました。
ここで起こっている物事は非常に複雑なのですが、これらの変化は、炎症性サイトカインであるIL-12を減少させ、抗炎症性サイトカインであるIL-10を増加させるようであり、α2-3Siaの刺激は、結果として全体的に炎症を抑える方向に系を動かすことが示されました。