米国CDCのCOVID-19チームが報じたPfizer-BioNTech と Moderna ワクチンの有効性
米国CDC COVID-19 チームは、Pfizer-BioNTech や Moderna ワクチンの有効性調査の結果を報告しています。
https://www.cdc.gov/mmwr/volumes/70/wr/pdfs/mm7018e1-H.pdf
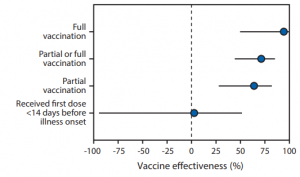
チームは、その結果として、Pfizer-BioNTech 或いは Moderna ワクチンの完全接種を受けた人のワクチン有効性は、94% (95% CI = 49%–99%)、部分的なワクチン接種を受けた人で 64% (95% CI = 28%–82%)と報告しました。
本研究においては、65歳以上で、COVID-19症状を示して2021年1月1日から3月26日の間に入院し、RT-PCRで確認された417名を対象としています。この中には, 187人の症例患者と230人の対照が含まれています。症例患者とは、一回以上のSARS-CoV-2 RT-PCRテストを受けて陽性と認められた人、対照とはRT-PCRで陰性と認められた人であります。また、この研究の参加者は、ワクチン接種を受けたことがCDCワクチン記録など公的な記録と自己申請で確認された人達です。
COVID-19の症状を発症する14日以内に、第一回目のワクチンの接種を受けていてもその効果はほとんどないということには注意しましょう(ワクチン有効性 = 3%, 95% CI = −94%–51%)。