KRAS遺伝子変異を伴う膵管腺癌における糖鎖修飾変化について
筑波大学医学部らのグループは、KRAS遺伝子変異を伴う膵管腺癌の糖鎖修飾変化について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10963106/
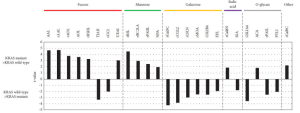
KRAS遺伝子変異のある膵管腺癌では、フコシル化とマンノシル化が昂進していることが示されました。
KRAS変異体で反応が強くなったレクチンには、フコース結合レクチン (AAL、rAAL、AOL、rAOL、rRSIIL、UEAI) およびマンノース結合レクチン (rRSL、rBC2LCA、rPAIIL、NPA) が含まれていました。