抗体医薬品(mAb)を作るに適したCHOの最適化:糖鎖をG0F構造に絞り込む
第一三共のグループは、抗体医薬品としてのmAbを製造するCHO細胞について、その培養条件の最適化を図っています。
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0250416
著者らは、CHOの培養に低分子化合物を添加することで、mAbの生産性を上げ、糖鎖構造の制御も合わせて行うことを考えています。
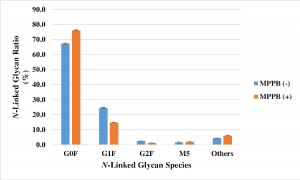
23,277種類の低分子化合物からスタートし、mAbの濃度が120%以上に増加、生産性が105%以上に増加、CHO細胞の生存率が80%以上であることというスクリーニング条件を経て、最終的に残った数個の低分子化合物の中から、4-(2,5-dimethyl-1H-pyrrol-1-yl)-N-(2,5-dioxopyrrolidin-1-yl) benzamide (MPPB)が選択されました。MPPBの濃度は、0.32 to 0.64 mMであり、mABの生産性は結果として1.5倍に上昇したとのことです。
糖鎖構造についてもG0Fがメインとなり、G1Fの割合が24.5%から14.8%に低下しました。その他の構造については変化はないようです。