新型コロナウイルス(SARS-CoV-2)に感染しても発症しないようにすればよい:ウイルスとの積極的共存の可能性について、ウイルスに打ち勝つ術
常々ブログ著者が考えていることと同じような内容が下記の論文に書かれていましたので、それを参考にしながら記事にまとめてみました。
A group from Central University of Tamil Nadu, etc.
https://academic.oup.com/femspd/article/79/1/ftaa076/6027506
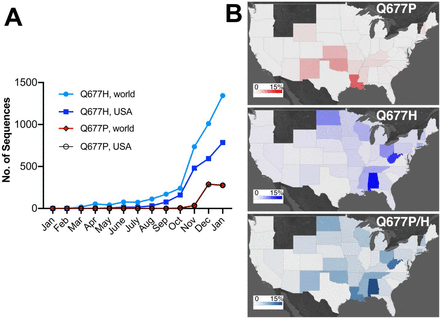
新型コロナウイルス(SARS-CoV-2)に感染しても無症状者がかなりの割合で存在します(80%に達するという報告もあります)。一般的にSARS-CoV-2に感染して発症するまでの潜伏期間は、5,6日ですが、14日に及ぶ場合もあります。しかし、無症状の場合は、平均19日と潜伏期間が長くなるようです。
SARS-CoV-2に感染すると、STING経路が活性化され、NLRP3インフラマソームの活性化がそれに追い打ちをかけて、IL-1β, IL-18, TNF-α, IFN-γ, IL-6らサイトカインの産生を過剰に促し、サイトカインストームを引き起こします。しかしながら、コウモリは、各種ウイルスのリザーバーでありながら、自身は発症しません。コウモリの場合は、その進化の過程において、次のような特徴を備えることでウイルスと共存していると考えられます。
(1)単球におけるNLRP3インフラマソームの過剰な産生が抑制されている、
(2)PYHIN遺伝子欠損により外因性DNAを検知する能力が低下している、
(3)抗炎症性サイトカインIL-10の分泌が多い、
(4)NK細胞に機能性キラー細胞Ig様 (KIR)受容体, キラー細胞レクチン様(KLR)受容体が欠損している。
ヒトの無症状者の場合は、炎症性サイトカインのレベルも低く、SARS-CoV-2特異的なIgGもかなり低いということが分かっています。つまり、無症状であるということは、免疫反応が弱いことの結果とも考えられます。また、逆に、無症状である理由の一つには、通常の風邪のコロナウイルス(229E, HKU1, OC43, NL63)に対するIgGの交差反応の結果という考えもあります。
ウイルスとの積極的共存という意味において、コウモリで発見されたメカニズムは、ヒトにおけるCOVID-19に対する治療戦略の開発を示唆している可能性が高いと思われます。それこそがウイルスの脅威から生き残る知恵なのかもしれません。