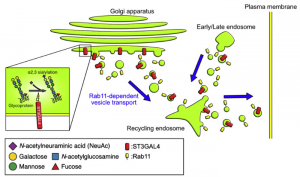
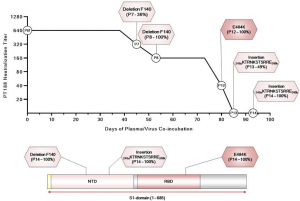
Vitamin Cと新型コロナウイルス(COVID-19)
University of Helsinkiらのグループは、Vitamin Cと新型コロナウイルス(COVID-19)の関係について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7848027/
健常者ですと、血中のVitamin C濃度を維持するには、0.1g/day程度のVitamin C摂取量で事足ります。しかし、COVID-19に感染して重症化すると、血中のVitamin C濃度が激減し、Vitamin C欠乏症と同程度、更には、ほとんど検出されないレベルにまで下がってしまう場合もあります。
大量のVitamin C(6~8g/day)を摂取することで、以下のような効果が得られるということです。
ICU治療期間を平均8%短縮
致死率を35%から78%に低減
Vitamin Cには副作用がないので、これも一つの治療法として有効であると考えられます。