HIV感染におけるPSGL-1の影響について
Department of Biological Sciences, University of Toronto Scarborough, 1265 Military Trail, Toronto, ON Canadaらのグループは、P-セレクチン糖タンパク質リガンド-1 (PSGL-1/CD162) がHIV-1のウイルスエンベロープに発現しており、それがウイルスの捕獲と、感染細胞 (CD4+ T-細胞など)へのトランスファーを媒介していると報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9123692/
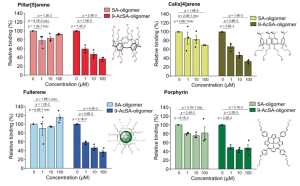
P-セレクチン糖タンパク質リガンド-1(PSGL-1/CD162)は、その受容体であるP-セレクチンとの相互作用を介して白血球のローリングを制御する役割について広く研究されています。構造的には、PSGL-1は高度に糖鎖修飾を受けたホモ二量体膜貫通タンパク質であり、細胞外ドメイン(ECD)の長さが50〜60 nmで、細胞表面から突き出ています。
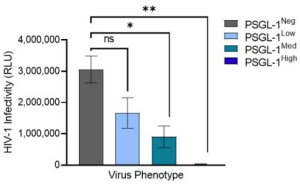
実際に、PSGL-1はHIV-1感染の生理学においてさまざまな役割を果たしています。以下に示すように、PSGL-1の発現レベルが高いウイルスは非感染性であることが示されています。
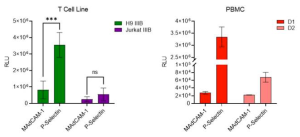
HIV-1感染の主な標的であるCD4+ T-細胞は、炎症状態でP-セレクチンを発現する活性化した内皮組織によく見られるため、P-セレクチンによって捕捉されるPSGL-1を発現するウイルスが近くの感染標的細胞に移動し、感染を引き起こす可能性があると考えられます。このモデルを、低レベルのPSGL-1と高レベルのgp120を発現するT-細胞感染ウイルスとPBMC感染ウイルスを用いて実証しました。T-細胞およびPBMCで産生されたウイルスが、コントロールよりも著しく高いレベルでP-セレクチンによって捕捉されることが示されました。最も重要なことは、両方のウイルスがP-セレクチンによって効果的に捕捉され、HIV-1の感染標的細胞にトランスファーされたということです。これは、HIVウイルスがin vivoでP-セレクチンを発現する細胞に遭遇した時、PSGL-1を介したウイルスの捕捉とトランスファーという感染のメカニズムが発生する可能性があることを示唆しているのです。