ロタウイルス-A、-B、-Cの糖鎖結合特異性の違い
Verna and Marrs McLean Department of Biochemistry and Molecular Biology, Baylor College of Medicine, Houston, TX USAらのグループは、ロタウイルスのSpikeタンパク質VP4のフォールディング構造とその糖鎖結合特異性について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9072675/
ロタウイルスは、10の異なる種またはグループ(A〜J)に分類されており、グループA、B、C、およびHのロタウイルスは、人間と動物の両方に感染します。疫学的には、グループA、B、およびCが最も良く研究されています。グループAロタウイルス(RVA)および(程度は低いが)グループCロタウイルス(RVC)は、世界中のほとんどの胃腸感染症の原因病原体であり、グループBロタウイルス(RVB)は、幾つかの国における散発的な感染症の原因になっています。
ロタウイルスのゲノムは、6つの構造ウイルスタンパク質(VP)と6つの非構造タンパク質をコードする二本鎖RNAの11の分節で構成されています。ウイルス粒子は、VP2で作られたコア層、VP6で作られた中間層、および糖タンパク質VP7で作られた外殻からなる3層構造を持っています。プロテアーゼ感受性タンパク質で作られた60個のSpikeタンパク質VP4が、外殻のVP7シェルから伸びています。
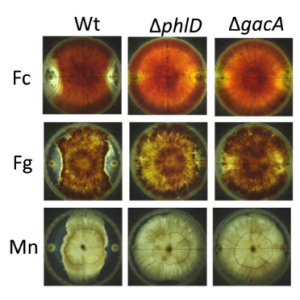
VP4をタンパク質分解処理すると、VP8*とVP5*の2つのフラグメントが生成されます。ロタウイルスグループ間の構造タンパク質の配列比較から、Spikeタンパク質VP4のVP8*ドメインが最もグループ間で変動していることが分かります。広範な構造研究により、ヒトRVAおよびRVC(VP8*AおよびVP8*C)にはガレクチン様ドメインがあり、その遺伝子型に依存して様々な細胞糖鎖を認識することが示されています。 VP8*AおよびVP8*Cの最も典型的な糖鎖結合特異性は、それぞれH-抗原およびA-抗原であることが知られていました。
興味深いことに、VP8*BはVP8*AまたはVP8*Cのいずれとも配列同一性を共有していません。これは、構造だけでなく糖鎖結合特性にも異なる影響を与える可能性があります。著者らは、VP8*Bには、VP8*AまたはVP8*Cとは全く異なるα-ヘリックスを留めるねじれたβシートを持つフォールディング構造が存在することを発見しました。更に、糖鎖アレイを用いたクリーニングおよびin silico分子ドッキング解析から、VP8*BがLacNAc構造を含む糖鎖を特異的に認識することを示しました。