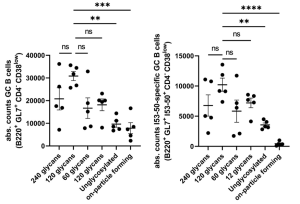
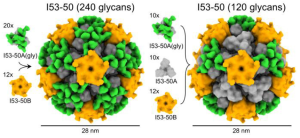
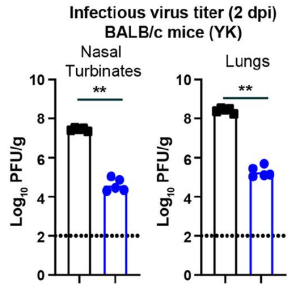
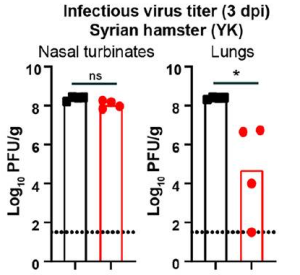
SARS-CoV-2に対するワクチンを未接種な場合、オミクロンに感染しても他の変異株に対する中和抗体の交差反応性は低い
Gladstone Institutes, San Francisco, CA, USAらのグループは、SARS-CoV-2のワクチン接種を受けていないヒトの場合、オミクロン変異株の感染は、他の変異株に対して有効な交差中和抗体を引き出さないが、ワクチン接種を受けたヒトでは、オミクロン感染は効果的にそれ自身のみでなく、他の変異株に対する中和活性も強化されると報告しています。
https://www.medrxiv.org/content/10.1101/2022.01.13.22269243v1.full-text
SARS-CoV-2の異なる株(WA1、アルファ、ベータ、デルタ、およびオミクロン)の感染によって誘発される免疫応答を決定するために、感染したマウスの血清を収集し、SARS-CoV-2に対する中和活性が評価されました。デルタ感染マウスの血清は、変異株に対して最も広範な交差反応性を示し、ベータを除くすべての系統を効果的に中和しました。比較して、オミクロン感染はオミクロン自体を効果的に中和しましたが、他の変異株に対しては限定的な交差中和を示すに留まりました。 WA1に感染したマウスの血清は、WA1、アルファ、およびデルタに対して効果的な中和活性を与えましたが、ベータおよびオミクロンに対しては中和活性を示しませんでした。これらの結果は、他の変異株と比較してオミクロンによって誘導される免疫は限定的であることを示しており、多くの変異を持つスパイクタンパク質や複製能力が低いことにその原因があると考えられます。
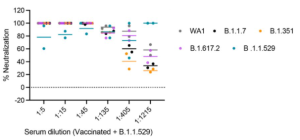
ヒトの場合、興味深いことに、オミクロンのブレイクスルー感染が確認されたワクチン接種を受けた個人の血清は、以下に示すように、オミクロンを含むすべての変異株に対して最高レベルの防御(> 80%)を示しました。