ビール酵母マイクロカプセルの免疫受容体の相互作用を標的とする経口ドラッグデリバリーシステムの可能性
REQUIMTE-LAQV, Department of Chemistry, University of Aveiro, Portugalらのグループは、ビール酵母マイクロカプセル(BSY)を用いる経口ドラッグデリバリーシステムの可能性について述べています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9857821/
BSYマイクロカプセルは、1M KOHまたは4M KOHによるアルカリ抽出法、または180℃或いは200℃での亜臨界水抽出(SWE)法を用いて抽出されました。得られたマイクロカプセルは、胃腸の消化状態を模倣したin vitro 消化 (IVD) で処理されました。消化されなかった物質は、マイクロカプセルの凝集と変形が見られるにもかかわらず、球形を維持し、(β1→3)-グルカンが豊富な構造となっていました。
SWE抽出マイクロカプセルのIVD処理から得られた可溶性多糖類はDectin-1と相互作用し、1M KOH抽出マイクロカプセルのIVD処理で放出されたものはDC-SIGNと相互作用し、4M KOH抽出および 180℃SWE抽出マイクロカプセル可溶化多糖類は、Dectin-2 と相互作用することが確認されました。
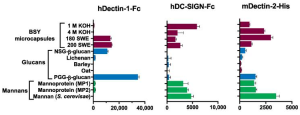
これらの結果は、生物医学的応用のための経口ドラッグデリバリーシステムとして、BSYマイクロカプセルが使用できるという可能性を示しています。

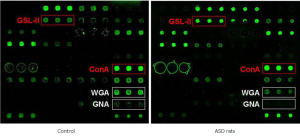
 PNA staining in proximal colon
PNA staining in proximal colon