オミクロンは、鼻腔上皮でデルタよりも100倍増殖し易い、しかし、その原因はhACE2に対する結合力が上がっていることだけではない
Department of Infectious Disease, Imperial College London, UKらのグループは、SARS-CoV-2 オミクロンのヒト鼻腔上皮細胞(hNEC)におけるより高い感染力と、その考えられる理由について報告しています。
https://www.biorxiv.org/content/10.1101/2021.12.31.474653v1
SARS-CoV-2 オミクロンは、ヒト鼻腔上皮細胞で感染初期の増幅力が高く、感染後24時間までにデルタよりも約100倍高い増殖力を示しました。感染後48時間を過ぎると、オミクロンはデルタと比較して低下し始め、72時間では、オミクロンは少なくなっていました。 Vero-ATセルでは、2つの変異株の増殖率は同等でしたが、Calu-3細胞では、オミクロンは、すべての時点でデルタよりも低くなっていました。
デルタなどの以前のSARS-CoV-2変異体は、ACE2に結合し、細胞表面プロテアーゼTMPRSS2を介して融合を活性化することによってのみ効率的に細胞に侵入することができます。しかし、オミクロンは、エンドソーム制限を回避する能力を進化させて、TMPRSS2依存および非依存の両方の方法で細胞に侵入することができるようです。これにより、オミクロンは、ACEとTMPRSS2が両方発現昂進している細胞だけに頼るのではなく、気道内のACE2発現細胞に感染することができることが増殖率アップの大きな原因であろうと考えられます。
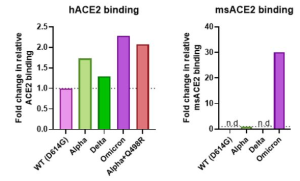
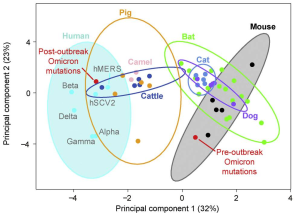
他に幾つかの報告例もありますが(本ブログでも2022年1月5日に紹介)、オミクロンのSpikeタンパク質は、以前のどの変異体よりもマウスのACE2(msACE2)によく結合することもわかりました。これは、オミクロンがヒトからマウスにジャンプし、その宿主内で変異を蓄積し、そしてヒトに戻ってきた可能性があることを示唆しています。