Department of Chemistry, Massachusetts Institute of Technology, MS, USAらは、ヒトのマンノース特異的レクチンの各々に特異的なマンノシル化高分子を開発しました。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8549053/
糖鎖結合性タンパク質(レクチン)は、病原菌に結合し自然免疫を活性化するように、多様な細胞認識、シグナリングに重要な役割を果たしています。レクチンをターゲットにする、特に免疫細胞表面に発現するそれらをターゲティングするということは、免疫や創薬に大きく貢献する可能性があります。レクチンは多量体を形成していることが多く、それ故、結合するリガンドのほとんどは多価であります。レクチンをターゲティングする場合の有効な方法は、ポリマーをバックボーンとして単一の糖鎖エピトープを多重に乗せることであります。しかしながら、このような多価のリガンドの欠点というのは、単糖特異性を共有するレクチンのそれぞれを区別することが出来ないという事です。例えば、マンノース単糖特性を持つレクチンには、DC-SIGN、DC-SIGNR、MBL、SP-D、langerin、dectin-2、mincle、DEC-205などがあります。
著者らは、これらのマンノース特異的レクチンをより正確にターゲティングできるようなマンノシル化高分子を開発しました。
ターゲットのマンノシル化糖高分子を生成するために、(R)-または(S)-グリシジルプロパルギルエーテル(GPE、> 99%ee)から始まる反復指数関数的成長(IEG)サイクルを実行して、正確に8、16、または32のアリル側鎖を持つ高分子を作り上げます。この時に、すべて(R)(アイソタクチック)、すべて(S)(アイソタクチック)、および交互(R-alt-S)(シンジオタクチック)の3つの異なる高分子構造を作り上げました。そして、この高分子にマンノース残基を付加するために、これらをUV光(λ= 365 nm)下でβ-チオマンノースナトリウム塩と反応させました。
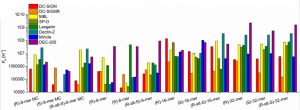
結合アフィニティーは、サンプル間で数ケタ以上変わっていました。例えば、DC-SIGNのKA値は、(S)-8merに対して 1 × 104 から(R)-16merに対して、1 × 108 にまで変化しています。Dectin-2の場合でも、1 × 104 から1 × 108に変化していますし、DEC-205の場合には、すべての高分子に 1 × 106 から 1 × 109で強く結合し、(R)-32merの場合で最も強いアフィニティー 2.2 × 109を示しました。
このように、同じマンノース単糖特性を持つレクチンに対して、広いレンジのアフィニティーを実現できていることは驚異的です。