National Centre for Biological Sciences (TIFR), Bengaluru, Indiaらのグループは、SARS-CoV-2 感染におけるエンドサイトーシスを利用した感染経路の重要性について述べています。
https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1009706
ウイルス感染におけるキーとなるステップは、ウイルス遺伝子の宿主細胞の細胞質内への放出にあります。これを行うために、ウイルスは細胞膜上の特定の受容体に結合し、引き続いて直接的に細胞膜と融合、あるいはまたエンドサイトーシスによる取り込みに引き続いて細胞膜融合を行います。この両方の細胞感染ルートは、SARS-CoV-2 の感染において起きているようであり、宿主細胞膜上の受容体やプロテアーゼの可用性に依存しています。Angiotensin converting enzyme 2 (ACE2) がSARS-CoV-2の良く知られた受容体でありますが、他の受容体(C-型レクチンなど)や共受容体(ヘパラン硫酸など)が数多くのグループから報告されています。 加えて、SARS-CoV-2 は、侵入を果たすには、宿主細胞のプロテアーゼによるウイルスのSpikeタンパク質の切断を必要とします。それ故、ウイルスは、もしもSpikeタンパク質が細胞膜上のTMPRSS2のようなセリンプロテアーゼによって切断される場合には、細胞膜上で直接的に融合し、そうでない場合には、エンドーライソソーム経路を細胞膜融合に使用し、そこではSpikeタンパク質は、システインプロテアーゼである cathepsinによってSpikeタンパク質がプライム状態になります。このようにして、宿主細胞におけるウイルスの侵入と感染は、これらのキーとなる要素、すなわち受容体(ACE2など)やプロテアーゼ(furin, TMPRSS2, cathepsin)の存在によって大きく影響されます。
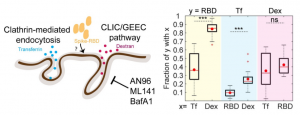
CLIC/GEEC (CG) 経路は、clathrin-非依存のエンドサイトーシス経路(CLICs)である細管小胞輸送(tubulovesicular primary carriers)によって媒介されます。細管小胞は細胞膜から直接的に発生し、その後グリコシルホスファチジルイノシトール(GPIアンカー)濃縮小胞(GEECs)と呼ばれる細管小胞へと成熟していきます。
著者らは、ACE2の発現をコントロールした胃上皮細胞(AGS)を用いて、SARS-CoV-2 Spikeタンパク質のRBDのエンドサイトーシスを研究しています。AGSは、通常ではACE2を発現していない細胞株として認識されています。 このAGSにおいては、RBDは、clathrin-mediated endocytosis (CME) 経路ではなく、CG 経路によって取り込まれており、AGS細胞における薬理的な擾乱に敏感であることがわかりました。
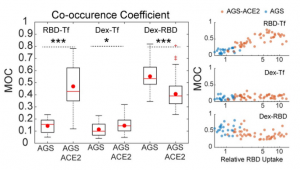
AGS細胞におけるACE2の効果を調べるために、ACE2を異所的に発現させた安定株(AGS-ACE2)を作りました(ACE2 の発現は、qPCRとウエスタンブロットによって確認されました)。このように改変したAGS-ACE2 細胞においては、RBDの取り込みは、AGS細胞に比べて3倍ほど増加していました。AGS-ACE2細胞におけるRBDの取り込み経路を確認する中において、RBDとトランスフェリンの増加が同時に起こっており、AGS細胞と比較してRBDとdextranの同時取り込みが減少していることがわかりました。 このことは、CG経路に加えて、AGS-ACE2細胞においては、CME経路を介したRBDの取り込みが支配的になっていることを示唆します。
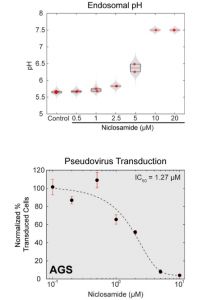
最後に、niclosamide がエンドソーム内pHを中性化し、SARS-CoV-2の感染を抑えることができることが下図のように示されました。治療薬としての可能性を示すものです。