Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing, Chinaらのグループは、バチルス・チューリンゲンシスから抽出したタンパク質、Cry78Aa、の結晶構造について報告しています。
https://www.nature.com/articles/s42003-022-03754-6
バチルス・チューリンゲンシス、およびその殺虫性タンパク質を発現する遺伝子組み換え植物を使用した生物学的防除方法は、一部の害虫に対して効果的かつ経済的であることが証明されています。Cry78Aaは、イネウンカを効果的に殺すバチルス・チューリンゲンシス C9F1 株から同定された新規タンパク質であり、ヒメトビウンカ および トビイロウンカに対する中央致死濃度 (LC50) 値は、それぞれ 6.89 および 15.78 μg/mLです。Cry78Aaのこういった殺虫効果の活性は、in vitro の活性化や追加操作を必要としないため、フィールド試験への適用に非常に便利とされています。
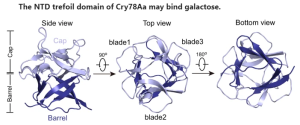
この論文では、Cry78Aaの結晶構造が詳細に分析されました。この構造は、二つの独立したドメインで構成されています。S-型レクチンと最も高い同一性を共有する N-末端のトレフォイル・ドメインと、エアロリシン ファミリーに属する毒素としての細孔形成ドメインです。バイオアッセイ試験では、Cry78AaのNTDまたはCTD 単独では、ウンカ幼虫に対して毒性を持たないことを示しており、その殺虫活性は両方のドメインが強調して働くことで発現するものと考えられます。 Cry78AaのNTDは、レクチン機能を持ち、おそらく細胞膜表面のタンパク質または脂質に結合したガラクトース型糖鎖を認識することによって、その殺虫活性に重要な役割を果たすようです。