State Key Laboratory of Analytical Chemistry for Life Science, School of Chemistry and Chemical Engineering, Nanjing University, Nanjing, Chinaのグループは、AFP-L3をマーカーとして使用し、AFP-L3を鋳型として作られたプローブ(MIP)を用いた肝臓がんの診断方法について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9020343/
triMIP-PISAと呼ばれる新しい戦略は、糖タンパク質疾患バイオマーカーの糖鎖修飾の変化を検出することにより、より正確な疾患診断を行う技術として開発されました。この方法は、モノクローナル抗体の特性に近い優れたタンパク質認識特性、およびレクチンよりも優れた優れた単糖認識特性を組み合わせています。
この方法は、3つの異なるタイプの鋳型分子プローブを用いた糖タンパク質バイオマーカーの認識とプラズモニック検出を統合しています。
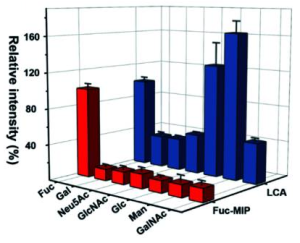
N末端エピトープインプリント基板を使用して臨床サンプルから標的糖タンパク質を特異的に抽出し、次に捕捉された標的分子をラマンレポーター1でカプセル化されたC末端エピトープインプリントナノタグで標識し、糖タンパク質のフコース化糖鎖をレポーター1とは異なる特徴的なラマンピークを持つラマンレポーター2でカプセル化されたフコース(Fuc)インプリントナノタグで標識します。このようにして基板上に形成されたサンドイッチ様免疫複合体を、プラズモニック検出します。
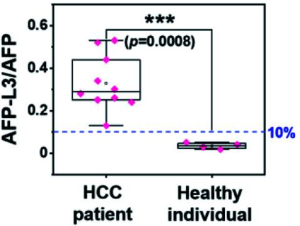
本研究では、この方法を、AFP-L3をマーカーとして使用するHCC診断に適用しています。レポーター1を含むナノタグによって生成されたラマン信号は総AFP量を表し、レポーター2を含むナノタグによって生成されたラマン信号はAFPのフコース化糖鎖(L3とも呼ばれる)の量を示します。このようにして、ヒト血清中のAFPの総量(AFP-L3/AFP)に対するフコース化糖鎖を持つAFPの相対的な発現レベルは、HCC患者の信頼できる特異的な指標をとなります。 AFP N末端エピトープインプリント基板のKd値は、LCAレクチンよりもはるかに小さい10 -9Mレベルに達しています。