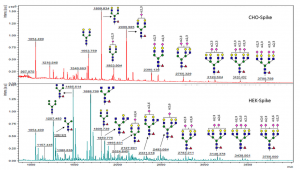
CHOとHEK細胞で発現させたSARS-CoV-2 Spikeの糖鎖修飾の違い:HEK細胞の方がOligomannose構造が増加する
Center for Biologics Evaluation and Research, Food and Drug Administration, Baltimore, MD, USAらのグループは、SARS-CoV-2 SpikeをCHOとHEK細胞で発現させた場合の糖鎖修飾の違いについて述べています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8497748/pdf/fchem-09-735558.pdf
CHO細胞の場合には、SARS-CoV-2 Spikeの糖鎖修飾は、二分岐複合型N型糖鎖が多く、且つα2-3Siaの修飾を強く受けています。それに対してHEK細胞の場合には、Oligomannose構造が増加しており、シアル酸修飾も減少しています(α2-6Siaの方が多くなる)。