月: 2021年6月
Human Surfactant Protein Dが新型コロナウイルス(SARS-CoV-2)感染を阻害するらしい
National Cheng Kung University, Taiwanらのグループは、human surfactant protein D が、SARS-CoV-2感染に対して感染阻害という観点で潜在的な治療効果を有すると述べています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8161545/
Human surfactant protein D (SP-D) は、コレクチンの一種であり、コラーゲンを含んだC-型レクチンであり、肺の恒常性や免疫にかかわる肺サーファクタントに含まれています。 このSP-Dのリコンビナントフラグメントである(rfhSP-D)がSARS-CoV-2に対する感染阻害効果を持つかどうかを調べるために、SARS-CoV-2 Spikeタンパク質を発現する偽レンチウイルスを使用して感染実験が行われました。rfhSP-D は、SARS-CoV-2 S1 に対してドーズ依存的に結合し、この結合はmaltoseやEDTAで阻害されました。また、この実験では、SARS-CoV-2 RBDがない場合には、rfhSP-Dは全く結合しませんでした。
rfhSP-D と Spikeタンパク質の結合がEDTA や maltose によって阻害されるということは、rfhSP-D がSARS-CoV2 Spikeの糖鎖に結合しているということを示唆するものです。偽レンチウイルスの感染効率を調べるためにルシフェラーゼ・レポーター・アッセイが使用されました。ACE2を過剰発現するように遺伝子導入されたHEK293Tに対してSARS-CoV-2を未処理で感染させたときのに比較して(これを1 RLUとする)、rfhSP-D (5 or 10 µg/ml) の処理で、0.5 RLUに蛍光が減少しました。この顕著な蛍光の減少は、rfhSP-Dの処理がSARS-CoV-2の感染を阻害していることを示しています。
これらの実験結果は、rfhSP-D の SARS-CoV-2 感染に対する潜在的な治療効果を示すものです。
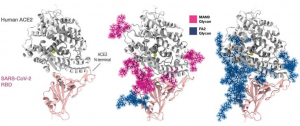
ACE2とSARS-CoV-2 RBDの結合に対する糖鎖修飾(Oligomannoseおよびbi-antennary complex N-glycan)の影響
Los Alamos National Laboratoryらのグループは、SARS-CoV-2のRBDとACE2との結合性に対する糖鎖の影響を分子動力学を用いて検討した結果を報告しています。
https://www.mdpi.com/1999-4915/13/5/927
ACE2に6個のOligomannose (MAN9)が Asn53, Asn90, Asn103, Asn322, Asn432, Asn546の位置に修飾され、SARS-CoV-2のRBDにbi-antennary complex N-glyucan(FA2)がAsn343の位置に修飾されているとした場合と、これらすべての糖鎖修飾位置がbi-antennary complex N-glycanであるとした場合をモデルとして結合力を計算しています。下図では、MAN9は赤色で、FA2は青色で示されています。
結果、ACE2の糖鎖修飾がMAN9である場合には、結合力が14.7%減少し、それがFA2である場合には、9.1%上昇することが示されました。
ACE2の修飾をhigh mannose型にした場合は、感染力が若干下がるという実験結果があり、矛盾はしていないようです。
また、N501Y変異で、何故感染力が上がるかについても計算されており、芳香環のπーπ相互作用の影響が指摘されています。この点については、既に過去のブログ記事で同様な研究例を紹介しています。
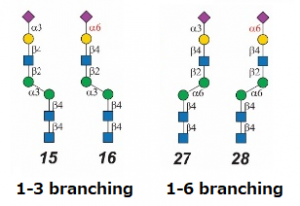
SiglecのN-型糖鎖結合特異性について:糖鎖アレイを用いた実験から
Georgia State Universityらのグループは、Siglecの糖鎖結合特異性について、糖鎖アレイを用いて検討した結果を報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8116747/
Siglec-3、-9、-10 は、α1-3 branching構造の場合にはSiaα2-6Galβ1-4GlcNAcに対するアフィニティーが強く、逆にα1-6 branching構造の場合には、Siaα2-3Galβ1-4GlcNAcに対するアフィニティーが高いことが分かりました。更に興味深いことに、Siglec-10は、Neu5Gcに対するアフィニティーが高いことが分かりました。
SARS-CoV-2を含む強い病原性を持つウイルスによって引き起こされるサイトカイン・ストームの特徴について
強い病原性を持つウイルスは通常サイトカインン・ストームをひき起こし、体組織に副作用的にダメージを与え、死亡率を高めます。
Sichuan Agricultural University, Chinaらのグループは、各種ウイルス(コロナウイルス (SARS-CoV, MERS-CoV, and SARS-CoV-2)、インフルエンザウイルス (2009H1N1, H5N1 and H7N9)、エボラウイルス、HIV、デングウイルス、ジカウイルス、西ナイルウイルス、HBV、HCV、エンテロウイルス)によって引き起こされるサイトカイン・ストームの特徴を解析し、次の三つの特徴を描き出しました。
https://www.frontiersin.org/articles/10.3389/fimmu.2021.659419/full
IP-10、L-6、IL-8、IL-17が最も増加するサイトカインである
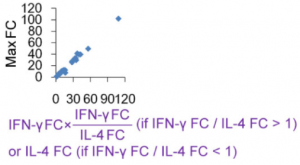
IFN-γ と IL-4 の変化が全てのサイトカイン・ストームの増幅率を決定する
IL-4とIFN-γが免疫応答の開始と制御に大きく関わっています。というのも、これらは相互に相反する機能を持っているからです。IFN-γ はTh2-細胞の分化を阻害し、Th1-細胞を安定化させます。IL-4は、逆にTh2-細胞の分化を誘導し、Th1-細胞の分化を阻害します。サイトカインストームの増幅率は、IFN-γ Fold Change(FC)/IL-4 FCという比で表現されるべきで、もしもIFN-γ FC/IL-4 FC が1よりも小さい場合は、増幅率は逆数の IL-4 FC/IFN-γ FCという比で表現されます。[IFN-γ FC × (IFN-γ FC/IL-4 FC) (if IFN-γ FC/IL-4 FC > 1)] 或いは [IFN-γ FC × (IL-4 FC/IFN-γ FC) (if IFN-γ FC/IL-4 FC < 1)] と最大FCの間の相関係数は、何とR2 = 0.988に達しました。
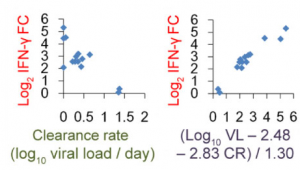
ウイルス量はIFN-γ FCと正に相関し、ウイルス排除速度はIFN-γ FCと負に相関する
SARS-CoV-2のARDSで命を落とした患者の検死結果が物語るCOVID-19の病理:ウイルスがマクロファージに直接感染する
Karolinska University Laboratoryらのグループは、COVID-19のARDSが死亡の直接の原因である12名の患者の検死から、新たな病理知見を報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8141733/
COVID-19で引き起こされるARDSにおいては、肺は液体で満たされて重く、広範囲にゴム状に硬化していました。このプロセスは、肺細胞におけるウイルスの増殖によって引き起こされ、肺胞上皮や肺胞毛細血管と肺胞内空間との間のバリアの破壊が大規模に進んだ結果です。この破壊が進行するにつれて、浮腫液や更には全血が肺胞空間に流れ込み、肺胞空隙が消失します。 血液凝固のカスケードが始まると、フィブリンの蓄積が進み、肺胞内の血液も凝固してしまいます。重要なことは、肺細胞のほんの少数しか溶菌感染を起こしておらず、大部分の肺細胞は細胞質の膨れ、小胞変性、核異型というような形での細胞変性効果を示しているということです。
興味深いことに、ウイルスは肺細胞やマクロファージで増殖しており、気管支上皮や内皮、周皮細胞、間質細胞では増殖しておらず、その感染機構の詳細は分からないものの、マクロファージらの食細胞がウイルスを取り込んで直接自身が感染していることを示唆するものです。
ここで見られる肺の硬化は、CD163+マクロファージや骨髄系細胞の大規模な蓄積、過剰な上皮細胞や間質細胞の増殖反応、あふれんばかりの血管新生らを伴っています。 このような肺の硬化をひき起こす内皮のダメージは、ウイルス感染による直接的な細胞変性ではなく、大規模なバイスタンダー効果によって引き起こされたと考えられます。恐らく、ウイルスが感染した肺細胞から放出されるアポトーシスを誘導するORF3aらの液性因子によって誘起されたものと考えられます。
前立腺癌の尿中マーカーについて:PSAのフコース修飾が前立腺癌の進行で減少する
弘前大医学部のグループは、前立腺癌に対する尿中マーカーとその診断法に関するレビューをしています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8100853/
今日現在、FDAが認可した前立腺癌(PC)に関する診断マーカーはただ一つしかありません、それは血中PSAです。 前立腺癌が進行すると、α-2,3-Sia (S2,3PSA) と α-2,6-Sia (S2,6PSA) の比率が変動し、α-2,3-Siaが増加することが知られています。
α2,3-linked Sialyl N-Glycan-Carrying Prostate-Specific Antigen
しかしながら、同じ結果は、尿中のPSAには当てはまらず、シアル酸修飾は尿中では殆ど変化しません。
尿中PSAの場合には、PSAのフコース修飾が前立腺癌のマーカーになる可能性があります。前立腺癌では、Lewis型やコア・フコース修飾を受けたPSAが顕著に減少することが分かっています。これらは、例えば、AALやPhoSLと言ったレクチンを使って検出することが可能です。また、コア・フコース修飾されたPSAが生検サンプルのGleasonスコアーと良く相関することも分かっています。Gleasonスコアが7以上の場合で、 PSA-AALでACU=0.69 (P=0.0064)、PSA-PhoSLで0.72 (P=0.0014)という値が得られています。
Decreased fucosylated PSA as a urinary marker
miRNAのプロファイルがCOVID-19の優れたマーカーとなり得る
University Hospital Arnau de Vilanova and Santa Maria, Spainらのグループは、miRNAのプロファイルがCOVID-19の優れたマーカーとなり得ることを報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8149473/
血中のmiRNAの発現レベルをCOVID-19の入院患者とICU患者の間で比較を行いました。その結果、41種のmiRNAの内、10個に有意差が見られました。
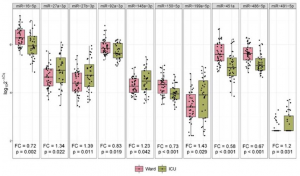
多変数モデル予測を用いて、入院患者とICU患者の判別を行った処、AUCは0.89に達しました(95% CI: 0.81-0.97)。この値は、COVID-19の重症度を判別するマーカーである既存のマーカーに比べて勝るとも劣らない数値です、因みにleukocyte counts (AUC=0.72)、D-dimer (AUC=0.87)、CRP AUC=0.72)であります。
更に、血中のmiRNAが重篤なCOVID-19患者を予測できるマーカーになり得るかについて検討が行われました。6個のmiRNAがICU治療を受けても生存できなかった患者において、優位に低下していることが分かりました(miR-16-5p (FC=0.69)、miR-92a-3p (FC=0.78)、miR-98-5p (FC=0.56)、miR-132-3p (FC=0.69)、miR-192-5p (FC=0.66)、miR-323a-3p (FC=0.66))。多変数モデル予測を用いて検討した結果、2個のmiRNA(miR-192-5p、miR-323a-3p)がその予測に有効であり、得られたAUCは0.80に達しました(95%CI: 0.64-0.96)。
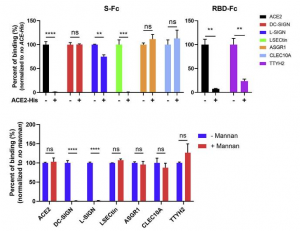
骨髄系細胞上のC型レクチン (DC-SIGN, L-SIGN, LSECtin, ASGR1, CLEC10A) が、COVID-19の過剰な免疫反応を誘起する
New York University Grossman School of Medicineらのグループは、骨髄系細胞(単球、樹状細胞、マクロファージらに分化)のC型レクチンが、COVID-19の過剰な免疫反応を誘起すると報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8106883/
骨髄系細胞に発現する5つのC型レクチン受容体(DC-SIGN、L-SIGN、LSECtin、ASGR1、CLEC10A)およびTweety family member 2 (TTYH2)のcDNAをトランスフェクトしたHEK293T細胞と、ヒトのIgGのFc部を融合させたSARS-CoV-2 Spike、S1、RBDとの結合性を調べました。HEK293Tに遺伝子導入によって発現させた骨髄系細胞のそれら受容体が、SARS-CoV-2の感染受容体とされるACE2とは無関係に、SARS-CoV-2と結合することが明確に示されました。DC-SIGN、L-SIGN、ASGR1、CLEC10Aは、Hisタグ付きの可溶性ACE2を加えても、その結合は全く阻害されませんでした。しかし、ACE2自身とLSECtinはHisタグ付きの可溶性ACE2よって見事に阻害されました。また、DC-SIGNとL-SIGNの結合は、Mannanを添加することで完全に阻害されました。
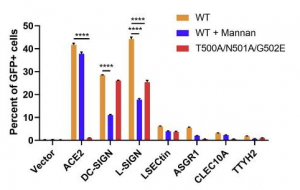
更に、SARS-CoV-2 Spikeタンパク質を発現するようにしたGFPをエンコードしたHIVベースのレンチウイルス(SARS-CoV-2 偽ウイルス)を用いても同様な実験が行われました。上記のようにして作られたHEK293TとSARS-CoV-2 偽ウイルスを共培養すると、ACE2を発現するようにしたHEK293Tと同じように、強いGFPの信号がDC-SIGNとL-SIGNのそれらからも観測されました。 LSECtin、ASGR1、CLEC10AおよびTTYH2からのGFPの信号は非常に弱かったのですが、furin や TMPRSS2 を共発現するようにしたものでは、その信号が強調されました。Spikeタンパク質の実験で、Mannanで結合が阻害されたように、この場合でも、DC-SIGN、L-SIGNのSARS-CoV-2偽ウイルスによって誘起されたGFPの信号は、Mannanによって見事に阻害されました。これらのデータは、SARS-CoV-2 偽ウイルスでも骨髄系細胞の受容体がSARS-CoV-2のSpikeタンパク質と変わらぬ関係性を維持していることを示しています。
RNAが糖鎖修飾を受けているという信じがたい発見
Stanford Univ.らのグループは、small noncoding RNAが糖鎖修飾の三番目の足場になるという驚くべき発見をしました。
https://pubmed.ncbi.nlm.nih.gov/34004145/
糖鎖修飾を受けたRNA(GlycoRNAと命名)の存在は、次のようなプロトコルを用いて実証されました。著者らは、細胞をperacetylated N-azidoacetylmannosamine (Ac4ManNAz)を用いて代謝的にラベリングした後、RNAをTRIzolで抽出し、エタノールで沈殿させ、シリカカラムで脱塩化し、高濃度のproteinase K digestionによってタンパク質を除去し、シリカカラムで再精製しました。RNAを精製した後、DBCO-biotinを加えて結合させ、streptavidin-IR800を用いて可視化しました。
糖鎖修飾を受けるRNAの足場は、micro noncoding RNAであることが分かりました。GlycoRNAの大部分は細胞膜表面に存在し、少なくとも一つのシアル酸修飾を受けた複合型N型糖鎖で修飾されていることが分かりました。また、GlycoRNAはSiglecと直接的に結合することが示されました。
現在の生物学では、N型糖鎖修飾の足場としては、RNAは除外されています。このGlycoRNAの発見は、現在の生物学に問題があり、RNA糖鎖ワールドという新しい視点を加えるべきものであることを主張しています。更に、細胞内外の相互作用を介在制御する細胞表面の新しい複合糖質の存在可能性を謳っているのです。