HIVの抗体はSARS-CoV-2の糖鎖抗原に結合するが、中和することはできない
University of British Columbia, Canadaのグループは、HIVの抗体がSARS-CoV-2を中和化できるかどうかについて議論しています。
https://www.nature.com/articles/s41598-021-91746-7
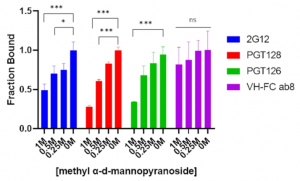
HIVの抗体3種(2G12, PGT128, PGT126)のSARS-CoV-2への結合性をmethyl α-d-mannopyranoside(安定化されたmannoseアナログ)存在下でELISAアッセイを用いて評価しました。methyl α-d-mannopyranoside の濃度が上昇するとともに、これら抗体の交差反応性が阻害され、これら3種のHIV抗体はSARS-CoV-2に対して糖鎖を介して相互作用していることが分かります。
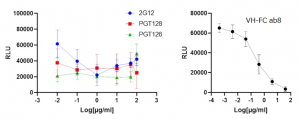
luciferase reporter geneを導入したSARS-CoV-2疑ウイルスを用い、ACE-2を過剰発現したHEK293-T 細胞への感染阻害実験が行われました。感染48時間後に、細胞ライセート中のLuciferase発光を測定しています(RLU: relative luciferase units)。 これら3種のHIV抗体の場合には、しかしながら、広い濃度範囲に渡って中和活性は全く見受けられませんでした。一方で、SARS-CoV-2 RBDをエピトープとするVH-FC ab8抗体の場合には、中和活性を示すきれいな阻害効果が示されています。
しかし、ブログ著者が思うに、C-型レクチンを発現する免疫細胞(マクロファージなど)への感染に対しては、これらのHIV抗体でも中和できる可能性があるのではないでしょうか?