北大・次世代物質生命科学研究センターらのグループは、O-Mannose修飾を受けたα-ジストログリカンとガレクチンとの相互作用について、特にcore M1に着目した研究結果を報告しています。
https://www.nature.com/articles/s41598-022-22758-0
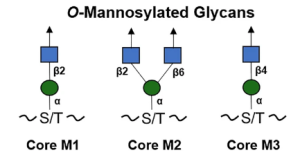
O-Mannose (O-Man) の修飾構造は、ヒトにおいては正常な発達に必要な限られたタンパク質にのみ見られるもので、筋肉および神経生理学において重要な機能を持っていることが分かっています。 α-ジストログリカン (α-DG) は、ジストログリカン (DG) の細胞外成分であり、最も広く研究されている哺乳類の O-Man 糖タンパク質です。骨格筋と脳で遍在的に発現し、細胞接着、筋肉の完全性、および神経学的発達に関連しています。 α-DG は、そのムチン様ドメインに、LacNac 末端を持つ3種類のO-man コア構造 (M1、M2、および M3) というユニークな糖鎖構造を持っています。
本研究では、ヒトのGal-1、-4、および -9 (-3 を除く) は、O-Man LacNAc 末端複合糖質と強く結合し、α2,3-シアリル化末端が存在すると、これらガレクチンの親和性が大幅に低下することが示されました。これは、このタイプの糖鎖修飾の伸長によって、このタイプの O-Man 糖鎖に対するガレクチン活性を微調整できることを示唆しています。更に、これらの相互作用はラクトースによって有意に阻害され、α-DG core M1 型糖鎖がガレクチンの標準的な糖結合部位 (S 面) に結合し、ガレクチンの受容体として機能することも確認されました。
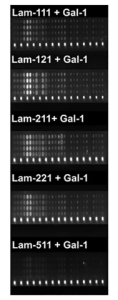
更に、Gal-1 は、マイクロアレイ実験で、ラミニン-111、-121、-211、および-221 (ただし-511 を除く) とcore M1 α-DG 糖ペプチドをリンクするトランスブリッジ型の結合を形成することが示され、筋ジストロフィーの治療において、ガレクチンが治療に使える可能性が示されました。