大阪大学微生物病研究所らのグループは、マウスのN-アセチルグルコサミン糖転移酵素-IVa(MGAT4A: GnT-IVa)のC-末端領域にレクチンドメインを発見したと報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9296478/
N‐型糖鎖におけるGlcNAc分岐の生合成は、特定のN-アセチルグルコサミン糖転移酵素(GnT)、GnT-Iから-Vによって触媒されます。
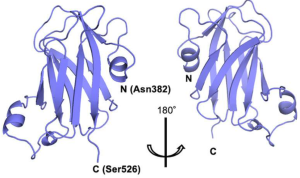
著者らは、N-アセチルグルコサミン糖転移酵素-IVaに存在するレクチンドメインが、3つの短いα-ヘリックスを持つ9つのβ-ストランドで構成されるβ-サンドイッチフォールド構造を形成していることを発見しました。このドメインは、GlcNAcに特異的に結合するレクチンとして機能する細菌CBM32にみられるそれと構造的および機能的に類似しています。
更に、GnT-IVaに存在するこのレクチンドメインは、細胞内の糖タンパク質基質への効率的なN‐型糖鎖の生合成に必要であることが分かりました。