Copenhagen Center for Glycomics, Department of Cellular and Molecular Medicine, Faculty of Health Sciences, University of Copenhagen, Denmarkらのグループは、IgGの受容体であるFcγRIIIaのN-型糖鎖修飾の影響について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9524020/
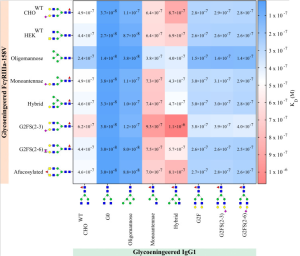
FcγRIIIaはIgGの受容体であり、主にNK細胞、マクロファージ、単球に発現しています。本研究では、FcγRIIIaとIgG1の間のアフィニティーに対するFcγRIIaのN-型糖鎖修飾の影響が調べられています。
期待されるように、全てのFcγRIIIa受容体で最高のアフィニティーを示すのは、IgG1-G0とIgG1-オリゴマンノースの両方でCore Fucoseが脱修飾されたIgGに対してでした。
興味深いことに、FcγRIIIaのN-型糖鎖修飾は、アフィニティーが2倍ほど増加するオリゴマンノシル化FcγRIIIaを除いて、Core Fucoseが脱修飾されたIgGでプローブした場合、アフィニティーにはほとんど影響がありませんでした。
最高のKD、即ち最低のアフィニティーを与えるのは、全てのFcγRIIIaに対して、IgG1のハイブリッド糖鎖修飾構造および IgG1のモノアンテナ糖鎖修飾構造でした。
一方、最低のKD、即ち最高のアフィニティーを与えるのは、Core Fucoseが脱修飾されたIgG1とオリゴマンノシル化FcγRIIIaの組み合わせでした。