新型コロナウイルス(COVID-19)で高齢者が重症化しやすいのは、従来型のヒト・コロナウイルス(HCoVs)との交差反応性の有無に由来する
新型コロナウイルス(COVID-19)では、高齢者、基礎疾患(糖尿病、脳血管疾患や高血圧など)があると重症化しやすいということが良く知られています。
高齢者と若年者の間の違いについては、若年者の方が自然免疫力が強い、高齢者では自然免疫と獲得免疫のバランスが崩れているなど、いろいろな議論があります。
下記のグループは、高齢者が重症化しやすいのは、従来型のヒト・コロナウイルス(HCoVs:NL63, OC43などの株)に特異的なT-細胞の交差反応の有無が関係しているのではないかと考えています。
https://www.nature.com/articles/s41598-020-78506-9
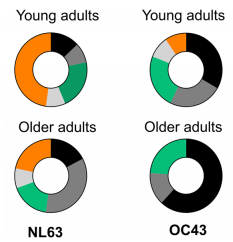
本研究より、ヒトα-HCoV(NL63)およびβ-HCoV(OC43)によって誘導される既存のT-細胞免疫が若年成人に存在するが、高齢者には事実上存在しないことが確認され、新型コロナウイルス(SARS-CoV-2)に向けられた交差反応性T-細胞の頻度は、ほとんどの高齢者で最小限だったとのことです。なるほど・・・、高齢者の重症化に関係していそうです。
IFN-γ 応答の違いを示す、
<10 (黒), 10–30 (ダークグレー), 30–100 (緑), 100–200 (ライトグイレー), >200 (オレンジ) SFU/10^6 PBMC.