ザクロの皮からの抽出物が、新型コロナウイルス(SARS-CoV-2)の抗ウイルス薬になるという
Arterra Bioscience SPA, Naples, Italyらのグループは、ザクロの皮からの抽出物(PPE)が、新型コロナウイルス(SARS-CoV-2)の抗ウイルス薬になる可能性を示しています。
https://www.frontiersin.org/articles/10.3389/fchem.2021.638187/full
ザクロの皮からの抽出物の二大成分は、プニカラギンとエラギタンニンです。
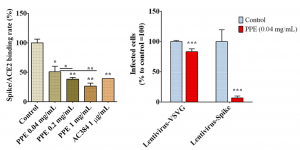
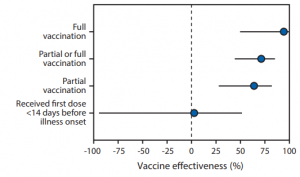
SARS-CoV-2 Spikeタンパク質とACE2の結合阻害実験が行われ、PPEが効果的に結合を阻害することが示されました(下図参照)。本実験において、AC384がコントロールとして使用されていますが、これはSARS-CoV-2のSpikeタンパク質とACE2の結合を阻害するモノクロ抗体です。
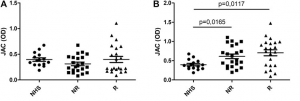
Human kidney-2 cells (HK-2)を用いての感染阻害実験も行われました。SARS-CoV-2 Spikeタンパク質をキャリーするレンチウイルスと、Vesicular stomatitis virus G (VSVG)タンパク質をキャリーするレンチウイルスが使用されました。PPEがSARS-CoV-2 Spikeレンチウイルスの感染を見事に阻害していることが分かります(下図参照)。
これらin vitroの実験結果は、PPEを用いた効果的で斬新な治療薬の開発を進める上において、非常に心強いものとなっています。