アプタマーを用いて糖鎖とペプチド構造を両方同時に認識させる:前立腺癌のマーカーであるPSAをモデルとして
Universidad de Oviedo, Spainのグループは、human prostate specific antigen (hPSA)の糖鎖とそのペプチド構造を両方同時に認識できるアプタマーをSELEXにて開発しています。
https://pubmed.ncbi.nlm.nih.gov/34094206/
hPSAの糖鎖とペプチド構造を両方認識させるアプタマーを開発するために、α1-6 core-fucoseに特異性を有するPhoSLレクチンを糖鎖修飾サイトに特異的なアプタマーを引っかける確率を上げる為に使用しています。
SELEXのプロセスは、磁気ビーズ(MPs)にhPSA或いは糖鎖を持たないrecombinant PSAを固定化することから始まります。BSAをブロッキング材として使用し、BSAに結合するアプタマーをBSA-MPsを用いて除去します。rPSA-MPsを用いて糖鎖修飾位置とは異なったタンパク質領域に結合するアプタマーを除去します。そしてhPSA-MPsを用いてPSAの糖鎖に結合するアプタマーのライブラリーをエンリッチします。
この後、ふたつのルートに分けますが、戦略Aでは、PhoSLでブロッキングすることにより、ブロッキングされたタンパク質に結合している分子をより厳格に除去する選択を行い、戦略BではPhoSL結合サイトに結合している分子を競合的にエルーションさせます。戦略Aでは、hPSAに結合するアプタマーは減少しますが、PhoSLを用いた競合的なエルーションは、hPSAに結合するアプタマーを増やすとともにその結合力を上げていきます。
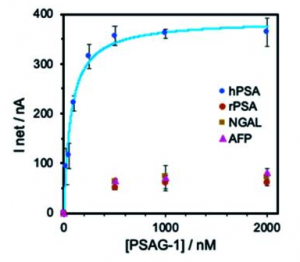
下図は、得られたアプタマー(PSAG-1)の結合特異性を示すものですが、ふたつのCure fucoseを持つタンパク質、lipocalin-2 (NGAL) と α-fetoprotein (AFP)が参照されています。前立腺癌に特異的な糖鎖構造をより精密に認識できるこのようなアプタマーが開発できれば、この方法に期待が持てます。