Fcγ受容体を介したエフェクター効果と抗体依存性感染増強 (ADE):SARS-CoV-2の治療用抗体に関して
Biological Defense Program, DSO National Laboratories, Singaporeらのグループは、SARS-CoV-2中和抗体のFcを介したエフェクター機能について研究しています。
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0253487
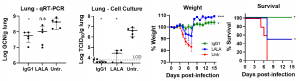
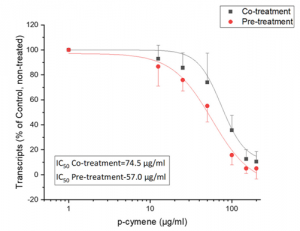
抗体依存性感染増強 (ADE)は、治療薬として抗SARS-CoV-2抗体を使用する場合の大きな懸念として存在しています。ADEは、Fcγ受容体が関与して、食細胞における感染を増強した場合に起こります。ADEの可能性を排除するために、Fcγ受容体が関係しない例えばIgG4アイソタイプを使用したり、FcγR-null LALA 変異を人工的に導入するというような手法がとられます。しかしながら、これらの手法は逆効果をもたらし、抗体の持つ能力を下支えするシグナルパス、例えばFcγ受容体を介したADCC効果、を殺してしまうはずです。この問題に答えるために、著者らはSARS-CoV-2回復期患者からRBDに結合する中和抗体IgG1を抽出し(SC31と命名)、その治療効果をそのLALA変異体と比較する実験を行い、SC31はADEを起こすことなく、Fcγ受容体がかかわるINF-γらの抗ウイルス応答を示しました。
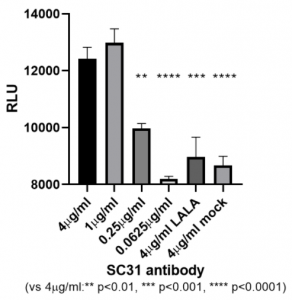
SC31の治療効果におけるFcγ受容体を介したエフェクター効果を確認するために、SC31とそのLALA変異体の比較を行っています。 FcγRIIIa ADCCシグナルパスの上流の活性化を評価するために、ADCC reporter assayを組み込んだFcγRIIIaを発現するJurkat reporter 細胞株を使用し、SARS-CoV-2 Spikeを発現するようにしたHEK293T株を共培養して、蛍光を測定しました。SC31のLALA 変異体とは異なり、SC31においては、ドーズ依存性を持ちながらADCCシグナルの活性が見られました。