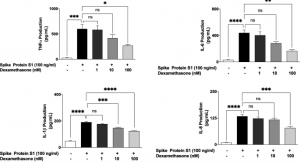
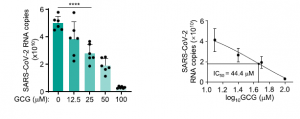
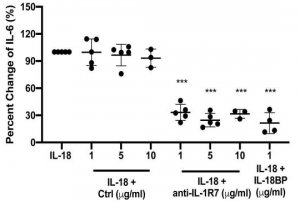
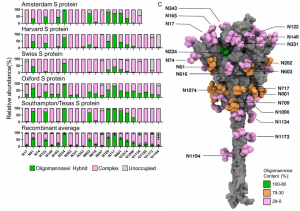
Hydroxychloroquine, Lopinavir, Ritonavirらの新型コロナウイルス(COVID-19)に対する有意な治療効果は認められなかった
McMaster University, Canadaらのグループは、COVID-19の治療薬としてのランダム化比較試験をHydroxychloroquine, Lopinavir, Ritonavirに対して行った結果を報告しています。
https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2779044
ランダム化比較試験はブラジルにて実施され、そのサンプルサイズは、hydroxychloroquineに対して214名; lopinavir-ritonavirに対して244名; プラセボに227名でありました。
ウイルスの排除に関して、hydroxychloroquine(odds ratio [OR], 0.91; 95% CI, 0.82-1.02)、lopinavir-ritonavir(OR, 1.04; 95% CI, 0.94-1.16)という結果にてコントロールに対して有意差は認められない結果でした。
因みに、
Hydroxychloroquine:抗マラリアまたは抗リウマチ薬、
Lopinavir:HIV感染症のHAART療法に用いられる医薬品、
Ritonavir:HIVやHCV感染症の治療に使用される医薬品、
であります。