Glyco26におけるレクチンアレイと糖鎖アレイの動向について
2023年8月27日~9月1日にかけて、台北のAcademia Sinica(中央研究院)において、Glyco26が開催されました。
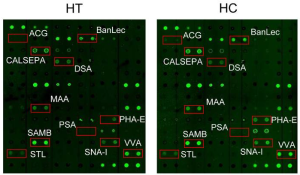
先ずはレクチンアレイ(レクチンマイクロアレイとも呼ばれる)の動向についてまとめてみたいと思います。
ご存知かと思いますが、レクチンアレイが登場したのは2005年であり、二つのグループ、米国のLara Mahalと日本のJun Hirabayashi、よりレクチンアレイを用いた糖鎖プロファイリング解析技術が論文化されました。下記は、Glyco26におけるUniv. of AlbertaのLara Mahalのプレゼン(D010)のひとこまです。

ご参考:Lara Mahalらのグループ
ご参考:Jun Hirabayashi, Atsushi Kunoらのグループ
後者の論文では、レクチンアレイを用いた糖鎖プロファイリング解析法として、これまた世界初の技術となりますが「エバネッセント波蛍光励起法」が採用されたことが記載されています。この方法は、スライドグラスに固定化されたレクチンとアナライトとしての蛍光標識された糖タンパク質の弱い相互作用を液相から非破壊にて直接的に検出することを可能にしたものです。実は、本ブログの管理人も本論文の共著者であり、この技術は糖鎖プロファイラー(GlycoStation® Reader 1200)として、管理人の手により、2007年に上市されました。
Glyco26におけるレクチンアレイを用いた、或いはまたレクチンアレイそのものに関する研究進展としては、前者に関しては、Academia Sinicaのグループと産総研のグループからの発表がありました。
Academia SinicaのWu-Show Suらのグループは、癌細胞が分泌するIL6の糖鎖プロファイリングにレクチンアレイを使用しており(A107)、産総研のAtsushi Kunoらのグループは、心繊維症のパラフィン固定サンプルを用いて、局所部位毎の糖鎖修飾の違いを検証していました。本研究では、進化したエムックの糖鎖プロファイラー、GSR2300、が使用されており、わずか細胞3個から糖鎖プロファイリングを取得することが可能であることが示されていました(C050)。
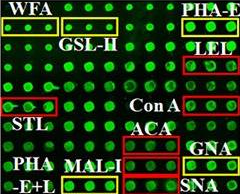
レクチンアレイに関しては、2つのグループから、ヒトレクチンのアレイ化に関するプレゼンがありました。
ICLのKurt Drickamerらのグループは、C-typeレクチン、ガレクチン、Siglecら合計31種のヒトレクチンを固定化したアレイを用いて、それらヒトレクチンと病原菌との結合特異性をスクリーニングしています。ヒトの自然免疫の最前線にいる各種レクチンが様々な微生物とどのように反応するかという独自の情報を提供するものであり、これによってヒトレクチンアレイの有用性が示されたとしています(D026)。本研究では、ヒトレクチンをBiotin化し、Streptavidinを敷いた基板上に糖鎖が固定化されていました。また、GlycoGeneticsは、ガレクチンをメインとして11種のヒトのレクチンを固定化した商品をアナウンスしていました(C072)。現存するレクチンアレイは、LecChipを代表例として植物レクチンを搭載するものが多く、ヒトレクチンを搭載するレクチンアレイは、レクチンアレイの新しい潮流であります。しかしながら、ヒトレクチンの糖鎖結合特異性は自然免疫系が中心でありそれほど糖鎖の網羅性は高くもなく、糖鎖プロファイリングという視点では、植物レクチンを中心とする従来型のレクチンアレイは十分に強力ですし、網羅性も高く(例えば、Slovak Academy of SciencesのJaroslav Katrilikらの植物レクチンを使ったアレイ(C053)も参考にできる)、従来型のレクチンアレイとヒトレクチンアレイは、使用用途毎に棲み分けが進むものと思われます。
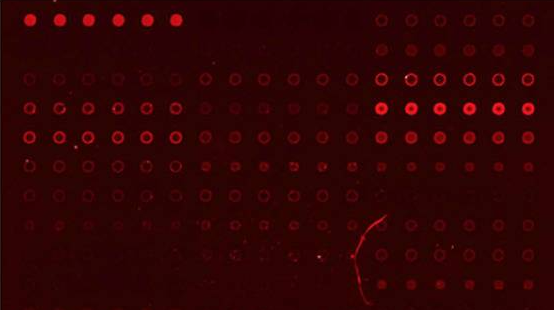
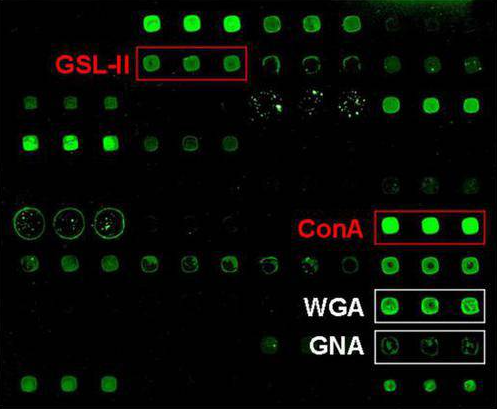
次に糖鎖アレイの動向に関してですが、ご存知のようにその網羅性の高さから米国CFGの糖鎖アレイが、デファクト的なポジションを占めています。この糖鎖アレイを用いて糖鎖結合性タンパク質の糖鎖結合特異性を評価しているプレゼンが幾つか見受けられました。Glyco26で最も注目されたこの分野でのプレゼンは、Harvard Medical SchoolのShang Chuen Wu, Richard Cummings, Sean Stowellらのグループによる「SARS-CoV-2のスパイクタンパク質が血液型Aに対して特異的な親和性を示す」というそれかも知れません(A071)。横浜市大のRyuhei Hayashi, Yashuhiro Ozekiらのグループは、独自の糖鎖アレイ(GlycoTechnica製)を用いて、カイメンレクチンの糖鎖結合特異性を議論していました。新規に見つかったChal18と名づけられたレクチンは、T-抗原に非常に強い特異性を示し、大腸癌細胞に対して強い細胞毒性を示すことも示されました(A031)。
糖鎖アレイに関する新たな潮流は、病原菌に特有な糖鎖をアレイ化する動きです。Academia SinicaのLaurriel Macali and Todd Lowaryらのグループは、66種類の微生物から切り出して精製した糖鎖を固定化した糖鎖アレイを用いてマイコバクテリオファージの糖鎖結合特異性を議論しています。本糖鎖アレイにおいては、糖鎖はネオグライコプロテイン法(即ち、切り出した糖鎖とBSAのコンジュゲートを作り、BSAをスライドグラス上に固定化する方法)を用いてスライドグラス上に固定化されています(A040)。
微生物の糖鎖は多岐に渡りその精製も大変です。更に、実際に微生物表面上で発現している糖鎖の状態と切り出してスライドグラス上に固定化した糖鎖では同一な存在状態ではないことから、Harvard Medical SchoolのHau-Ming Jan and Sean Stowellらのグループは、微生物をそのままアレイ化してしまう方法(microbe microarray: MMA)を提案し、Gal-8との相互作用を例として、MMAの方が糖鎖アレイよりもより正しく結合性を予測できるとしています(A048)。
Glyco26では、全発表数が343件もありましたので、管理人が全てを網羅できず、見落としているものもあるかも知れません。その点をご容赦頂きまして、この情報が少しでも皆様のお役に立てば幸いです。