多価のナノ・レクチンを用いてSARS-CoV-2を中和する
School of Chemistry and Astbury Centre for Structural Molecular Biology, University of Leeds, United Kingdomらのグループは、多価のナノ・レクチンを用いてSARS-CoV-2を中和する方法について報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10302749/
SARS-CoV-2のスパイクタンパク質三量体は、各単量体サブユニット上に22個のN-型糖鎖の修飾部位があり、オリゴマンノース、ハイブリッド、複合型糖鎖らの構造が存在することが知られています。スパイクタンパク質エピトープの変異により、SARS-CoV-2変異体はワクチン接種等によって誘起される免疫反応を回避してしまいます。対照的に、SARS-CoV-2変異体における糖鎖修飾部位の変異は非常にまれであるため、糖鎖は抗ウイルス薬開発の強力な標的となる可能性があります。従って、レクチンがSARS-CoV-2変異株に対して潜在的に強力な抗ウイルス活性を示す可能性があると考えられます。
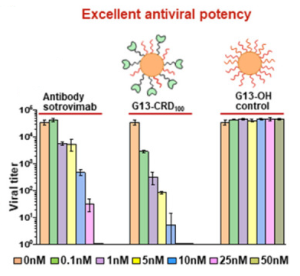
DC-SIGNの糖鎖認識部位(CRD)は、一価の低いアフィニティー(Kd-値: 0.1 ~ 3 mM)で、SARS-CoV-2を含むウイルス表面にあるマンノースおよびフコース含有糖鎖に特異的に結合することが知られています。レクチンである DC-SIGNのアフィニティーを高めるために、DC-SIGN CRDを金ナノ粒子(GNP)に多数結合させました。 13 nmサイズの金ナノ粒子(G13)を、H[AuCl4] のクエン酸還元によって合成し、まず初めに部分的にG13のPEG化を行いました。次に、これらのG13をリンカー標識されたDC-SIGN CRDとインキュベートし、多価のナノ・レクチンを得ました。
その結果、G13-DC-SIGN CRDは、初めての多価ナノ・レクチンとして、SARS-CoV-2変異体に対して幅広い活性を有することが示されました。