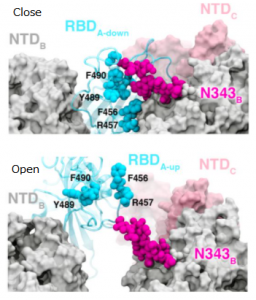
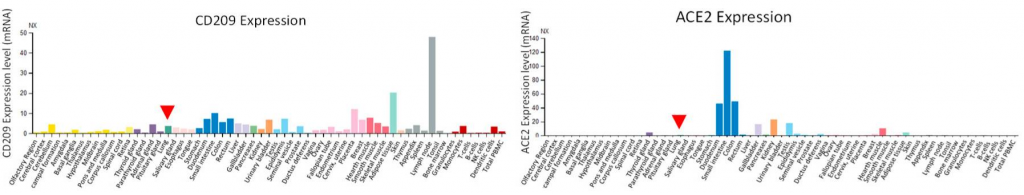
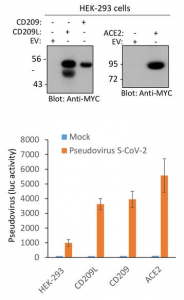
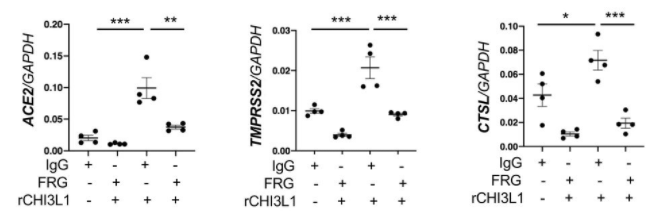
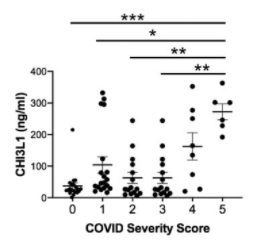
N343に存在するN型複合糖鎖がSARS-CoV-2のRBDのopen, closeの構造変化を制御している
UC San Diegoらのグループは、SARS-CoV-2のAVE2に対するRBDの配位(open or close)をN343の位置に存在する複合型N型糖鎖が制御していることを分子動力学的シュミレーションを用いて示しました。下図を見てもらえれば一目瞭然かと思います。
https://www.biorxiv.org/content/10.1101/2021.02.15.431212v1