2018年11月、2019年8月の牛乳から新型コロナウイルス(SARS-CoV-2)のIgGが発見された
順天堂大学らのグループは、牛乳のホエーから、新型コロナウイルス(SARS-CoV-2)のS-タンパク質に対する抗体(IgG)を発見しました。
https://www.sciencedirect.com/science/article/pii/S0958694621000303?via%3Dihub
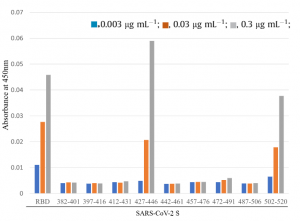
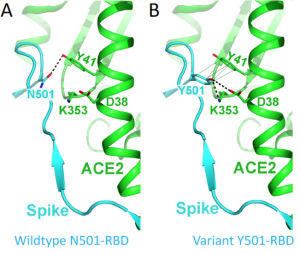
牛乳は、2018年11月、2019年8月にニュージーランドの牛から搾乳されたものであり、その牛乳のホエー中に、SARS-CoV-2のS-タンパク質に存在するRBDに対するIgGが存在していることを発見しました。S-タンパク質の遺伝子配列は下図のようですが、エピトープマッピングを行っところ、RBDにアフィニティーを持つことが分かりました。従って、牛乳のホエーからエンリッチしたIgGは、SARS-CoV-2に対する中和活性を示す可能性があります。
しかし、この牛乳は、新型コロナウイルスが蔓延する以前に搾乳されたものであり、牛がSARS-CoV-2に感染していたということは考えにくく、SRAS-CoV-2と免疫原生をシェアする未知のコロナウイルスに感染していたのかもしれません。