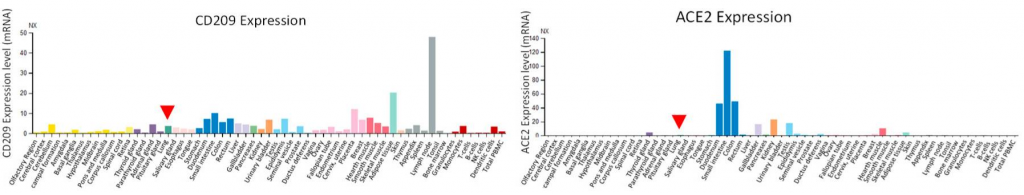
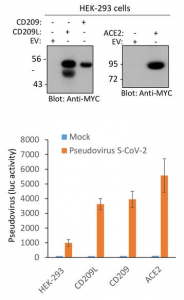
新型コロナウイルス患者(COVID-19)の中和抗体について、その有効期間は?
東大医学部らのグループは、2020年1月から4月の日本の新型コロナウイルス患者から、その中和抗体の力価の変動の様子を報告しています。
https://www.thelancet.com/journals/eclinm/article/PIIS2589-5370(21)00014-6/fulltext
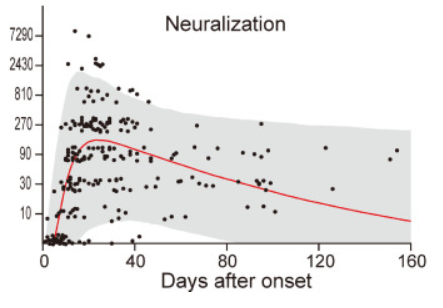
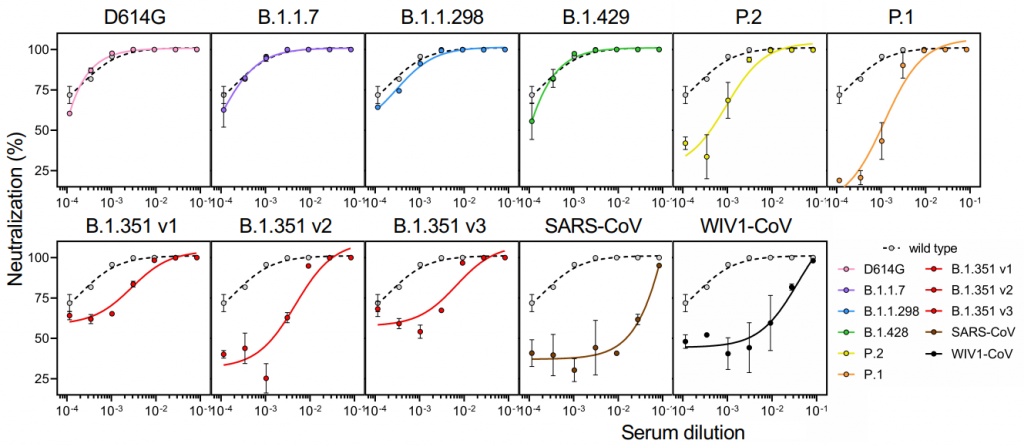
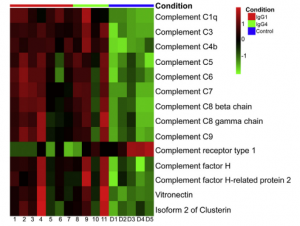
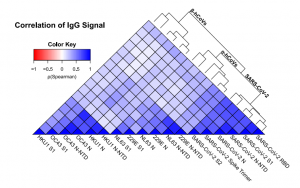
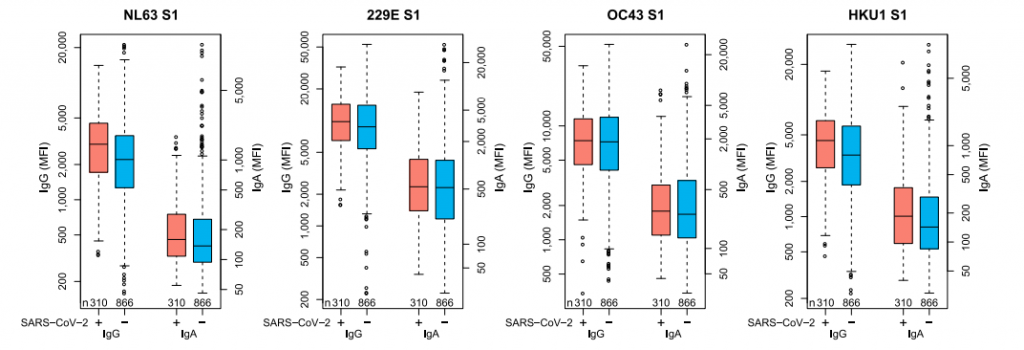
感染後も数か月間は、中和抗体の力価はそこそこ保たれるようです。下図で、グレーは95%CIの範囲を示します。赤線は中央値です。心配される抗体依存性感染増強(ADE)については、世界中で数多くの研究が行われているが、ADEが増強されたという報告はまだ見受けられず、SARS-CoV-2の場合は、ADEの可能性は低いのではないか?と言及しています。