Siglec-7のカウンター受容体がleukosialin (CD43)であると解明される
名古屋大学らのグループは、Siglec-7のカウンター受容体を同定したようです。
https://www.jbc.org/article/S0021-9258(21)00251-9/fulltext
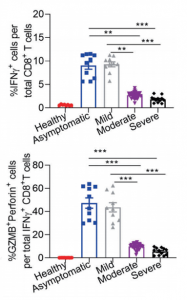
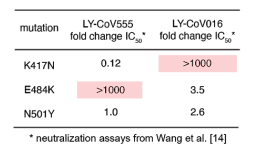
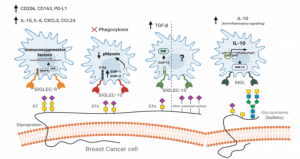
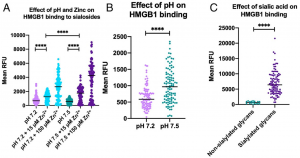
Siglec-7はシアル酸を認識し、主にナチュラルキラー(NK)細胞上に発現しており、癌細胞上のリガンドに反応すると免疫抑制的に作用することが知られていました。しかし、Siglec-7の受容体には完全には同定されていませんでした。著者らは、K562細胞からFc-融合Siglec-7、diSia-dextran polymerを用いて受容体を精製し、MSによりSiglec-7のカウンター受容体がleukosialin (CD43) であることを確認しました。さらに、K562細胞に対するNK細胞の細胞毒性は、シグレック-7依存的にleukosialinの過剰発現によって抑制されることを示しました。