Core2 GnT (O型糖鎖 Core2 GlcNAc転移酵素)の阻害が絨毛癌の治療に有効
名大医学部のグループは、C2GnT (O型糖鎖 Core2 GlcNAc転移酵素)の阻害剤が絨毛癌の治療に有効であることを報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7895715/
絨毛癌は、女性特有の病気にて、妊娠時の胎盤をつくる絨毛細胞(トロホブラスト)に発生する悪性腫瘍です。
NK細胞の表面にはNKG2Dという受容体があり、腫瘍にしばしば存在するクラスI鎖関連タンパク質A(MICA)と結合することで、NK細胞の細胞障害活性が引き出されると従来より考えられてきました。
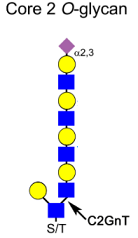
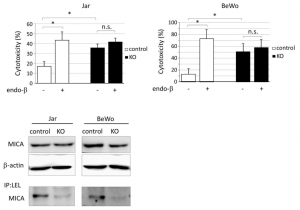
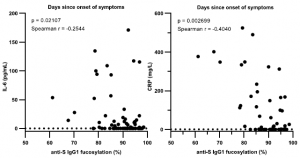
下図に示すように、LELレクチンでIPしたMICAは、C2GnTをKOすることで明らかに減少することから、MICAはpoly lactosamine構造を持つCore2 O型糖鎖修飾を受けていることが分かります。C2GnTをKOすることで、当然ながらpoly lactosaminの伸長は起こらなくなります。JarとBeWoは絨毛癌細胞株であり、NK細胞毒性に対して、C2GnTをKOした細胞とcontrolを比較した結果は、明らかにC2GnTのKOでNK細胞障害活性が上昇することを示しています。また、エンド‐β‐ガラクトシダーゼの処理は、poly lactosamineの構造を切断してしまいますので、C2GnT KOと同じようにNK細胞障害活性を促します。
つまり、これらの結果は、MICAのpoly lactosamine修飾がNK細胞毒性を押さえていることを示しており、C2GnTが高発現するほど、絨毛癌が免疫を回避してしまうことを示しています。すなわち、この阻害が絨毛癌の治療法に結び付く可能性があります。